椎间盘退变可引起多种临床综合征,不但给患者带来巨大的痛苦,也给社会带来很大的经济负担。这类疾病主要由退变的椎间盘对神经根和脊髓的机械压迫,或免疫反应引起化学性炎症刺激,或末梢神经纤维长入髓核组织内等复杂的发生机制引起 [1]。但究其根本,椎间盘退变是所有这些病理改
变的始动因素[2]。椎间盘退变的病理过程伴随着一系列复杂的细胞和生物化学的改变,其中包括椎间盘细胞数量的减少、椎间盘细胞外基质合成的下降以及分解的增加[3]。近年来,随着生物学技术的飞速发展,通过组织工程学方法阻遏甚至逆转椎间盘退变逐渐成为研究的热点[4-5]。
正常髓核组织亲水性强,含水量高达 80%,呈凝胶状,其细胞外基质成分主要是蛋白聚糖和Ⅱ型胶原蛋白,与软骨细胞的表型表达相类似[6]。因此,有学者尝试通过诱导骨髓间充质干细胞(BMSCs) 分化成为软骨细胞(类髓核细胞)来作为椎间盘组织工程髓核的种子细胞以修复椎间盘退变[6-8]。
骨形态发生蛋白 2(BMP-2)属于转化生长因子β(TGF-β)超家族,BMP-2 能诱导 BMSCs 分化成为软骨细胞和成骨细胞[9]。此外 BMP-2 还具有维持关节软骨细胞表型的作用[10]。富血小板血浆(PRP) 是从全血中获取的,含有大量的纤维连接蛋白及多种细胞生长因子,细胞外基质内的生物活性分子及其特殊空间分布提供了大量生物信号,有利于细胞的黏附、生长、分化和增殖[11-13]。本研究通过制备 PRP,并将其与 BMP-2 转染的 BMSCs 相复合,评价转基因的 BMSCs 在 PPR 内的生长和分化情况,以期为椎间盘退变组织工程学治疗获取理想的种子细胞和支架材料提供实验依据。
1 材料与方法 1.1 兔 BMSCs 的分离培养及纯化成年纯种新西兰大白兔 1 只,体质量 1 kg(第二军医大学实验动物中心提供)。用 30 g/L 戊巴比妥钠按 1 mL/kg 剂量经兔耳缘静脉行全身麻醉。常规消毒铺巾,于双侧胫骨近端做骨穿,穿刺成功后用含有 0.5 mL 肝素钠盐水的注射器抽取骨髓 4.0 ~ 5.0 mL,将骨髓转移至离心管,再加入等量的 PBS 洗涤,然后以 1 000 r/min 离心 5 min( 离心半径 10 cm),弃去上清液,加入培养液重悬,接种于 100 mL 的培养瓶中,于 37℃、体积分数 5% CO2 的培养箱中培养。3 d 后全量换液,去除悬浮细胞,原代培养细胞长满瓶底面积 80% ~ 90% 时,加入 2.5 g/L 胰蛋白酶消化2.0~ 3.0 min,加入含有血清的 LG-DMEM 培养液终止消化。1 000 r/min 离心 5 min(离心半径 10 cm),弃上清液,吹打细胞后以 1∶3 的比例接种,光镜下观察细胞的形态及生长状况。
1.2 兔 BMSCs 的鉴定选择第 3 代 BMSCs,消化离心后用 PBS 清洗细胞 3 次,计数细胞,各管依次加入单克隆抗体 CD29、CD105、CD166,同时每管样品设立同型阴性对照。避光冰上孵育 45 min,PBS 洗涤细胞 3 次,用 500 μL PBS 重悬细胞,上流式细胞仪进行检测分析。
1.3 重组腺病毒 Ad-BMP-2 对 BMSCs 的体外转染及鉴定取第 3 代培养的 BMSCs,待细胞铺满培养瓶底 80% 后,按转染复数(MOI)=100 分别加入 Ad-GFP-hBMP-2(上海鸣鸿生物科技有限公司构建)及 Ad-GFP 进行转染,即 BMP-2-BMSCs 组和对照组。通过荧光显微镜观察测定 GFP 阳性细胞的比例评价转染效率,转染 14 d 后用蛋白质印迹法测定 BMP-2 表达情况。
1.4 PRP 的制备成年新西兰大白兔肌内注射戊巴比妥钠麻醉后,无菌条件下耳缘静脉取血 5 mL ,用 10% 枸橼酸钠葡萄糖溶液 0.3 ~ 0.5 mL 预防凝血。采血样本以2400 r/min 离心 10 min(离心半径 15 cm),取得上层血清和交界层 1 mm 血细胞层,置于另 1 支无菌离心管中,以 3 600 r/min 离心 15 min(离心半径 15 cm),得到离心管底部黄褐色约 0.5 mL 的 PRP。将 60 IU 牛凝血酶溶解于 3 mL 质量浓度为 5 g/L 的 CaCl2 溶液中,作为 PRP 凝聚成凝胶的激活剂。
1.5 与 PRP 凝胶复合BMP-2-BMSCs 组取适量的 BMP-2-BMSCs 与 PRP混合成终密度为 1×108/mL 的 BMP-2-BMSCs 细胞悬液,对照组取 BMSCs 和 PRP 混合成相同密度的细胞悬液,取相同容量的 PRP 和 LG-DMEM 培养基混合做空白对照;随后往各组中加入激活剂(60 IU 牛凝血酶 +1 mL 10% CaCl2/10 mL PRP)制成凝胶。将凝胶复合物置于体积分数 5% CO2 的 37℃细胞培养箱中,加入细胞培养基(DMEM,10% FBS,1% 青霉素 / 链霉素),每隔 3 d 进行换液。用扫描电镜观察 PRP 凝胶复合物中的细胞生长情况,行 MTT 实验检测 RPR 凝胶中 BMSCs 的增殖情况,评价凝胶的细胞相容性。
1.6 PRP 凝胶中的 BMSCs 的成软骨分化检测用 RT-PCR 方法检测各组中成软骨分化基因的表达。采用 TRIzol 法提取各组总 RNA,应用 TaKaRa 公司反转录试剂盒按说明书进行 mRNA 反转录,分别进行Ⅰ型胶原、Ⅱ型胶原、Ⅹ型胶原、蛋白聚糖、 SOX-9 和 GAPDH 基因 PCR。引物序列如表 1 所示。扩增条件:变性(95℃,30 s)、退火(60℃,30 s)、 延伸(72℃,45 s),40 个循环。熔解曲线分析未发现非特异性扩增。
|
|
表 1 各基因引物序列 Table 1 Primer sequences for each gene |
用免疫细胞化学法检测各组细胞外基质Ⅱ型胶原的表达情况。制作 6 μm 厚的细胞冰冻切片,之后分别与兔抗人Ⅱ型胶原抗体孵育 1 h,然后加入生物素标记的二抗,用 AEC 底物显色试剂盒进行显色反应,最后予以苏木精复染,切片放置于光学显微镜下观察。
1.7 统计学处理应用 SPSS 19.0 软件对数据进行统计学分析。多组间数据的比较采用 Kruskal-Wallis H 检验,两两比较采用 Nemenyi 检验。以 P < 0.05 为差异有统计学意义。
2 结果 2.1 BMSCs 的形态观察及表面标记物鉴定24 h 后可见体外培养的原代 BMSCs 呈散在的纺锤形细胞贴壁,细胞呈放射状排列;5 ~ 7 d 后细胞铺满培养瓶底,细胞形态变为长梭形纤维样紧密排列,漩涡状生长,但形态差别较明显 ; 随着传代次数的增加,细胞形态逐渐一致。第 3 代 BMSCs 生长曲线表明传代细胞在大量增殖后第 5 天逐渐达到细胞生长平台期。流式细胞术结果显示细胞均一性 > 90%,细胞表面可以稳定表达 CD29、CD105 和 CD166 3 种 BMSCs 最为特异性的表面标记物(图 1),其中 CD29 表达率为(73.4±3.6)%,CD105 表达率为(49.7±2.5)%,CD166 表达率为(89.4±2.8)%。
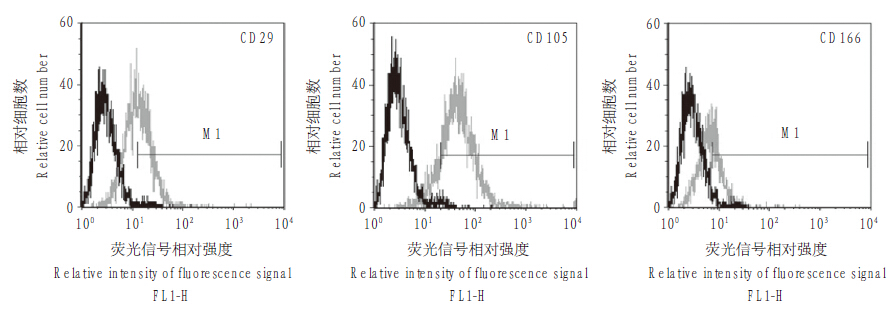
|
图 1 BMSCs 表面标志物检测结果 Figure 1 Testing results of surface markers of BMSCs |
BMP-2 转染 2 周后 GFP+ BMSCs 占细胞总数的 74.36%(图 2a,b),蛋白质印迹分析发现转染 2 周后 BMP-2-BMSCs 组较对照组的 BMP-2 表达水平明显升高(图 2c)。
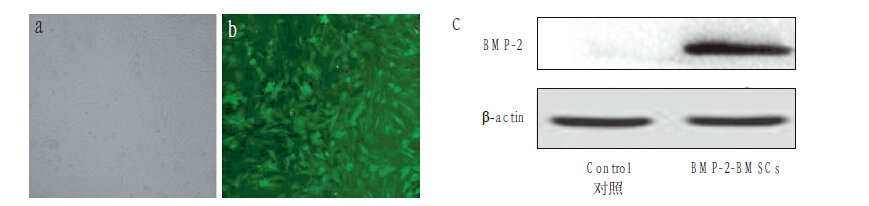
|
a:对照组GFP+ BMSCs(×10)b:BMP-2-BMSCs 组GFP+ BMSCs(×10)c:2 组蛋白质印迹分析结果 a:GFP+ BMSCs of control group(×10)b:GFP+ BMSCs of BMP-2-BMSCs group(×10)c:Western blotting analysis of BMP-2 in 2 groups 图 2 BMSCs 中BMP-2 转染效率的评价 Figure 2 Transfection efficiency of BMP-2 in BMSCs |
新鲜的 PRP 凝胶为类似果冻样胶体,大体观察可见大量的纤维彼此相互交织(图 3a)。将 PRP 凝胶与转基因细胞复合物行扫描电镜观察,结果显示凝胶内部结构呈纤维交织的立体网状结构,网状结构的孔隙直径大小不等,为 40 ~ 100 μm,复合物中见大量转基因 BMSCs 均匀分布,多数细胞伸出大量突起到纤维骨架和凝胶孔隙之中,除此之外还有大量的血小板附着于支架上(图 3b)。MTT 检测表明 BMP-2-BMSCs 组 BMSCs 增殖良好,与对照组相比差异无统计学意义(P> 0.05,图 3c)。以上结果证明了 PRP 具有良好的细胞生物相容性。
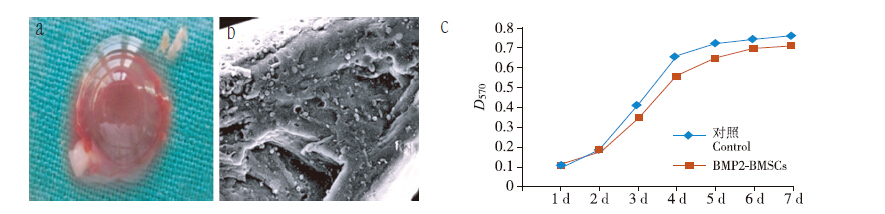
|
The biocompatibility of PRP gel a:Macroscopic observation of PRP and BMSCs mixtureb:Scanning electron microscopic results(×50 000)c:MTT results 图 3 PRP凝胶的细胞相容性评价 Figure 3 The biocompatibility of PRP gel |
转染后 3 周,RT-PCR 结果表明,单层培养的 BMP-2-BMSCs 组中Ⅱ型胶原、蛋白聚糖和 SOX-9 的表达水平高于对照组(P<0.05),Ⅰ型胶原表达水平低于对照组(P<0.05),而Ⅹ型胶原表达水平与对照组相比差异无统计学意义(P> 0.05,图 4a~e);免疫细胞化学结果表明,单层培养的 BMP-2-BMSCs 组可见明显的 Ⅱ型胶原表达,而对照组则未见Ⅱ型胶原表达(图 5)。与 PRP 凝胶的复合后,BMP-2-BMSCs 组的Ⅱ型胶原、蛋白聚糖和 SOX-9 表达水平高于对照组(P < 0.05),而 Ⅰ型和Ⅹ型胶原表达水平与对照组比较差异无统计学意义(P> 0.05,图 4f~j)。以上结果表明体外 BMP-2 基因转染能够促进单层或复合 PRP 的 BMSCs 向成软骨细胞分化,同时不会引起向肥大细胞的分化。
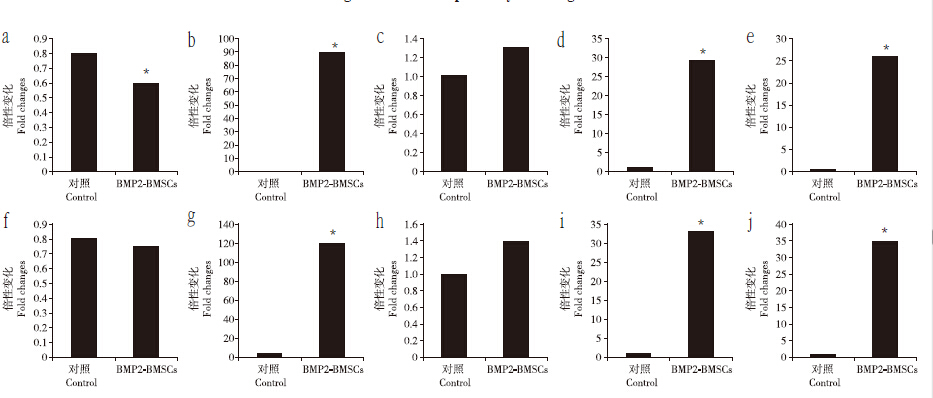
|
a ~ e:单层培养BMP-2-BMSCs 组的Ⅰ型胶原(a)、Ⅱ型胶原(b)、Ⅹ型胶原(c)、蛋白聚糖(d)及SOX-9(e)的RT-PCR结果f ~ j:与PRP 凝 胶复合后BMP-2-BMSCs 组的Ⅰ型胶原(f)、Ⅱ型胶原(g)、Ⅹ型胶原(h)、蛋白聚糖(i)及SOX-9(j)的RT-PCR结果* P < 0.05 a - e:Results of RT-PCR for the expressions of Type Ⅰ collagen(a),Type Ⅱ collagen(b),Type X collagen(c),aggrecan(d) and SOX-9(e)in BMP-2-transduced BMSCs in monolayerf - j:Results of RT-PCR for the expressions of Type Ⅰ collagen(f),Type Ⅱ collagen(g),Type Ⅹ collagen(h),aggrecan(i) and SOX-9(j) in BMP-2-transduced BMSCs in PRP gel* P < 0.05 图 4 BMSCs 成软骨分化结果 Figure 4 Chondrogenic differentiation of BMSCs |
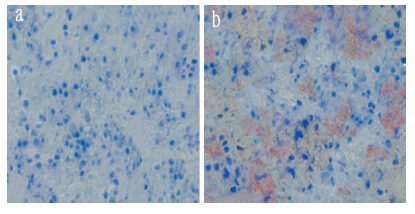
|
a:对照组b:BMP-2-BMSCs 组 a:Control groupb:BMP-2-BMSCs group 图 5 Ⅱ型胶原免疫细胞化学检测结果(×10) Figure 5 Cellular immunohistochemistrical results of type Ⅱ collagen(×10) |
椎间盘发生退变后,构成细胞外基质的主要成分Ⅱ型胶原和蛋白聚糖含量减少,进而造成椎间盘组织内含水量以及椎间盘高度逐渐降低,同时椎间盘负重关节面及其他结构也发生相应改变,随着蛋白聚糖进行性丢失,最终导致髓核脱水以及广泛的椎间盘变性的发生。随着基因技术的飞速发展,应用转基因的方法保持或提高椎间盘细胞外基质的含量成为预防和治疗椎间盘退变的一条重要策略。
BMP 属于 TGF-β 超家族成员,目前研究主要集中在 BMP-2 和 BMP-7 上。BMP-2 具有多种生物学功能,它对软骨表型的保持有着重要的作用,还能够调节细胞生长代谢和促进细胞外基质合成,并能延缓细胞凋亡进程[9]。具有活性形式的 BMP-2 是由 2 个相同蛋白组成的同源二聚体,也可以是由 2 个相关 BMP 形成的异源二聚体[10]。BMP-2 在体内以前体的形式合成,经蛋白酶切途径去除信号肽和前肽,得到由 114 个氨基酸残基组成的成熟肽。成熟肽通过 7 对二硫键将其保守结构正确折叠,此时成熟肽的同源或异源二聚体才具有生物活性。细胞分泌成熟肽是以自分泌或旁分泌形式来实现,受体为丝 / 苏氨酸Ⅰ型和Ⅱ型受体(BMPR-Ⅰ,BMPR-Ⅱ),活化的 BMP-2 受体磷酸化后,使其转移到胞核内,从而激活目的基因的转录[10]。
Leckie 等[14]将携带 BMP-2 的腺病毒注射入兔退变椎间盘模型中,之后 6 周与 12 周分别进行 MRI 检查、12 周取退变椎间盘进行组织学检测,影像学及组织学检查结果发现 BMP-2 注射组的椎间盘退变程度要显著低于对照组。此外,作者还通过血清学检测Ⅱ型胶原产物以及对椎间盘组织进行生物力学测试,证实了前述结论。梁伟国等[15]将 BMP-2 体外作用于培养的人退变髓核细胞,之后采取组织学检测以及蛋白质印迹实验证实 BMP-2 作用的髓核细胞基质外Ⅱ型胶原和蛋白聚糖表达上调。顾海伦等[16]通过将 BMP-2 作用于分离培养的髓核细胞,经过 RT-PCR 检测发现 BMP-2 与髓核细胞外Ⅱ型胶原以及蛋白聚糖存在剂量依赖效应,随着 BMP-2 的剂量增高,Ⅱ型胶原以及蛋白聚糖的表达亦随之上调。本研究通过腺病毒介导的 BMP-2 对兔 BMSCs 进行转染并获得成功,结果表明 BMP-2 可在体外持续表达,同时 BMP-2 能够在体外促进 BMSCs 向成软骨细胞分化,并且不会引起向肥大软骨细胞的分化。本研究结果为将 BMP-2 应用于椎间盘退变的基因治疗提供了实验依据。
生物支架材料是组织工程研究的基础,其为种子细胞的黏附、生长、繁殖提供支持。理想的椎间盘组织工程细胞支架材料应该能够模拟椎间盘基质形成的自然环境,为种子细胞提供近似于椎间盘细胞外基质的生物化学和生物力学适宜环境,同时应具备良好的生物相容性及可降解性;还应具有无毒、来源广泛、廉价、易加工的特点[17]。
人们已经尝试过许多材料作为组织工程中的细胞载体材料,包括天然的、人工合成的材料。天然材料包括各种基于胶原的载体材料,或者胶原和藻酸盐混合形成的凝胶剂,其最突出的优点是无抗原性,生物相容性好,与细胞外基质结构相似,参与组织的愈合过程,然而由于降解太快,在作为细胞支架时往往提前塌陷而达不到诱导新组织生成的目的[18]。人工合成多聚生物材料有聚羟基乙酸(PGA)、聚 L-乳酸(PLLA)以及二者的混合物,这些载体材料具有可塑性,有一定的强度,作为软骨组织工程支架材料能较好地诱导、促进软骨细胞的黏附、增殖和分化,形成软骨组织。主要缺点是降解较快,易出现崩解,使支架整体塌陷。而且由于降解过快,其降解产物羟基酸在局部积聚,会造成局部 pH 值下降,使细胞中毒乃至死亡[18]。此外,理想的椎间盘组织工程支架材料还应有利于营养、生物活性因子、氧气和代谢产物的扩散。这就要求支架材料应具有良好的三维立体结构,这样才能有利于细胞的黏附、生长和分化,同时有利于营养物质的运输和代谢产物的清除[19]。
本研究所采用的 PRP 中富含高浓度的生长因子,其可以促进细胞生长及组织修复。PRP 凝胶是三维的多孔结构,其最大优势在于完全来源于自体,无疾病传染风险及免疫排斥反应,制作较简单,且对组织损伤小,在临床上具有良好的应用前景。本研究证实 PRP 凝胶具有良好的组织相容性及完整的三维结构,激活后在透射电镜下呈有规律排列的多孔网状结构,有利于细胞的黏附、生长、分化和增殖。PRP 在与细胞复合过程中可以在充分混匀后再加入激活剂激活,使种子细胞在支架内均匀分布,避免了细胞只附着于支架材料表面或长入支架材料不充分的缺点,细胞于其中生长时可以伸出大量的突起进入凝胶内部网眼,使细胞在三维空间充分生长,避免了细胞之间接触抑制的出现,而且凝胶内部的网眼状结构还为细胞所需营养物质的进入以及代谢产物的排出提供了有利的条件。
在本实验中,BMSCs 经 BMP-2 转染后复合 PRP 凝胶,RT-PCR 及免疫细胞化学研究均证实其表达的椎间盘细胞外基质(Ⅱ型胶原和蛋白聚糖)水平明显高于对照组,表明转染 BMP-2 的 BMSCs 具有作为种子细胞的潜力。本研究结果为今后的椎间盘再生组织工程研究提供了理论基础和实验依据。
| [1] | Wang SZ, Rui YF, Lu J, et al. Cell and molecular biology of intervertebral disc degeneration:current understanding and implications for potential therapeutic strategies[J]. Cell Prolif , 2014, 47 (5) :381–390. DOI:10.1111/cpr.2014.47.issue-5 |
| [2] | Gou S, Oxentenko SC, Eldrige JS, et al. Stem cell therapy for intervertebral disk regeneration[J]. Am J Phys Med Rehabil , 2014, 93 (11 Suppl 3) :S122–S131. |
| [3] | Sivan SS, Wachtel E, Roughley P. Structure, function, aging and turnover of aggrecan in the intervertebral disc[J]. Biochim Biophys Acta , 2014, 1840 (10) :3181–3189. DOI:10.1016/j.bbagen.2014.07.013 |
| [4] | Sakai D, Grad S. Advancing the cellular and molecular therapy for intervertebral disc disease[J]. Adv Drug Deliv Rev , 2014, 84 :159–171. |
| [5] | Sharifi S, Bulstra SK, Grijpma DW, et al. Treatment of the degenerated intervertebral disc; closure, repair and regeneration of the annulus fibrosus[J]. J Tissue Eng Regen Med , 2015, 9 (10) :1120–1132. DOI:10.1002/term.v9.10 |
| [6] | Freemont AJ, Watkins A, Le Maitre C, et al. Current understanding of cellular and molecular events in intervertebral disc degeneration:implications for therapy[J]. J Pathol , 2002, 196 (4) :374–379. DOI:10.1002/(ISSN)1096-9896 |
| [7] | Vadalà G, Russo F, Di Martino A, et al. Intervertebral disc regeneration:from the degenerative cascade to molecular therapy and tissue engineering[J]. J Tissue Eng Regen Med , 2015, 9 (6) :679–690. DOI:10.1002/term.v9.6 |
| [8] | Risbud MV, Shapiro IM. Role of cytokines in intervertebral disc degeneration:pain and disc content[J]. Nat Rev Rheumatol , 2014, 10 (1) :44–56. |
| [9] | Carragee EJ, Hurwitz EL, Weiner BK. A critical review of recombinant human bone morphogenetic protein-2 trials in spinal surgery:emerging safety concerns and lessons learned[J]. Spine J , 2011, 11 (6) :471–491. DOI:10.1016/j.spinee.2011.04.023 |
| [10] | Tannoury CA, An HS. Complications with the use of bone morphogenetic protein 2(BMP-2) in spine surgery[J]. Spine J , 2014, 14 (3) :552–559. DOI:10.1016/j.spinee.2013.08.060 |
| [11] | Wang SZ, Rui YF, Tan Q, et al. Enhancing intervertebral disc repair and regeneration through biology:platelet-rich plasma as an alternative strategy[J]. Arthritis Res Ther , 2013, 15 (5) :220. DOI:10.1186/ar4353 |
| [12] | Gullung GB, Woodall JW, Tucci MA, et al. Platelet-rich plasma effects on degenerative disc disease:analysis of histology and imaging in an animal model[J]. Evid Based Spine Care J , 2011, 2 (4) :13–18. DOI:10.1055/s-0031-1274752 |
| [13] | Mietsch A, Neidlinger-Wilke C, Schrezenmeier H, et al. Evaluation of platelet-rich plasma and hydrostatic pressure regarding cell differentiation in nucleus pulposus tissue engineering[J]. J Tissue Eng Regen Med , 2013, 7 (3) :244–252. DOI:10.1002/term.v7.3 |
| [14] | Leckie SK, Bechara BP, Hartman RA, et al. Injection of AAV2-BMP2 and AAV2-TIMP1 into the nucleus pulposus slows the course of intervertebral disc degeneration in an in vivo rabbit model[J]. Spine J , 2012, 12 (1) :7–20. DOI:10.1016/j.spinee.2011.09.011 |
| [15] | 梁伟国, 叶冬平, 李锋生, 等. BMP-2对人退变椎间盘髓核细胞影响的实验研究[J]. 中国矫形外科杂志 , 2012, 20 (19) :1782–1785. |
| [16] | 顾海伦, 段景柱, 王欢. 人骨形态蛋白-2对椎间盘细胞蛋白多糖和Ⅱ型胶原的影响[J]. 中国组织化学与细胞化学杂志 , 2007, 16 (3) :283–287. |
| [17] | Martino S, D'Angelo F, Armentano I, et al. Stem cell-biomaterial interactions for regenerative medicine[J]. Biotechnol Adv , 2012, 30 (1) :338–351. DOI:10.1016/j.biotechadv.2011.06.015 |
| [18] | Hosseinkhani M, Mehrabani D, Karimfar MH, et al. Tissue engineered scaffolds in regenerative medicine[J]. World J Plast Surg , 2014, 3 (1) :3–7. |
| [19] | Yao X, Peng R, Ding J. Cell-material interactions revealed via material techniques of surface patterning[J]. Adv Mater , 2013, 25 (37) :5257–5286. DOI:10.1002/adma.201301762 |
 2016, Vol.14
2016, Vol.14  Issue(6): 356-361
Issue(6): 356-361


