腰椎椎间盘炎发生率较低,且病变早期缺乏特异性临床表现,易延误治疗而导致病情持续进展[1-3]。其治疗方法包括抗感染、手术清除病灶与植骨等,而对术中是否使用内固定维持脊柱稳定仍存争议[4-7]。从解剖入路角度考虑,前侧腹膜后入路容易到达位于脊柱前部的感染区域,便于进行病灶清除及植骨,同时也避免经腹腔手术造成的一系列并发症,因而被广泛应用于前路腰椎手术。目前,腹腔镜技术以其灵活、微创的特点在脊柱手术中得到广泛的应用,其能够减少开放显露过程中广泛组织分离造成的创伤,具有恢复快、出血少的优点。2012年5月—2015年6月,本院采用腹膜后腹腔镜技术治疗单节段腰椎椎间盘炎患者10例,现回顾分析相关资料,探讨该术式的近期疗效及可行性。
1 资料与方法 1.1 一般资料本组患者男7例,女3例;年龄27~63岁,平均45.9岁;病程5~16周,平均8.7周。病变均为单节段,其中L2/L3 2例,L3/L4 3例,L4/L5 5例。病史:上呼吸道感染2例,急性非淋巴细胞白血病M2型(ANLL-M2)化疗后粒细胞减少而并发肺部及尿路感染1例,腹腔脓肿(继发于腹部外伤性肠破裂)合并2型糖尿病1例,椎管侵入性损伤4例(腰椎椎间盘射频治疗3例、椎管内封闭1例),余2例无明确诱因。
1.2 临床表现和实验室检查本组病例均有腰痛及活动受限,程度较重,其中1例伴间歇性腹股沟及会阴区痉挛性疼痛、2例出现双髋部交替性胀痛,咳嗽及体位变化均能诱发或加剧腰痛,夜间疼痛加重,镇痛需使用强效麻醉药品。所有病例均无下肢放射痛及排尿、排粪障碍等神经症状。伴寒战高热(最高39.5 ℃)患者1例,低热(37.3 ℃~38.0 ℃)患者3例,余患者体温处于正常范围。查体发现所有病例均有不同程度的椎旁肌紧张,受累节段棘突有明显压痛及叩击痛,其中7例患者因腰背部牵拉诱发或加重腰痛而拒行直腿抬高试验;所有病例下肢感觉、肌力及腱反射均正常。本组病例入院时均行血常规、红细胞沉降率(ESR)、C反应蛋白(CRP)等指标的实验室检查,其中白细胞(WBC)计数增高2例,中性粒细胞比例增高4例,所有患者ESR和CRP均增高。入院血培养阳性者仅1例,为大肠埃希菌(腹腔脓肿患者);所有病例结核感染T细胞斑点试验(T-SPOT.TB)结果均为阴性。
1.3 影像学检查本组患者影像学资料(腰椎X线、CT及MRI)均完善。腰椎X线及CT示所有患者均存在椎间隙狭窄,7例患者椎体终板骨质破坏,3例患者椎体周缘硬化增生或骨桥形成。腰椎MRI示病变椎间盘及相邻椎体信号异常,T1WI表现为低信号,T2WI表现为高信号或高低混杂信号;其中5例可见椎管内软组织影突入致硬膜囊轻度受压。本组患者影像学均未见明显腰椎不稳及畸形。
1.4 手术方法本组患者因非手术治疗无效或无法忍受长时间抗感染及制动等原因进行手术。患者取仰卧位,左侧臀部垫高,取头低足低位。于左侧髂嵴内上2 cm作腹部纵行切口(A点),长约3 cm,穿透肌层后达腹膜后间隙,手指钝性分离,放置气囊于腹膜后,充气500 mL并维持3~5 min,继续钝性分离并在示指引导下于左侧腹壁另取3个长约1.5 cm的切口,分别置入相应的套管针(Trocar),作为腔内操作器械的工作通道及辅助通道,在A点置入相应的套管针作为腹腔镜工作通道,缝合切口后灌注CO2气体,建立腹膜后气腔。镜下清理腹膜后脂肪,显露腰大肌,腰大肌筋膜与后腹膜之间用超声刀游离,显露腹主动脉,C形臂X线机透视下使用钛夹初步定位目标节段,沿腰大肌前缘向后侧分离腰大肌,将腰大肌牵向后方,显露椎体侧方(显露过程中注意保护腰椎节段动脉,若动脉走行影响病变椎间隙的显露及病灶清除,可于远离椎间孔的位置使用钛夹将其结扎并切断)。于椎间隙内浅置1枚克氏针,C形臂X线机透视确认目标节段无误后纵行切开椎间盘纤维环,吸引清除脓液,摘除感染坏死髓核组织,清除脓苔、炎性肉芽组织,分别送病理检查、病原菌培养(细菌、真菌、结核分枝杆菌)及药敏试验。用大量稀碘伏液及生理盐水冲洗椎间隙,并予0.1 g异烟肼局部使用,彻底止血后于相应椎间隙放置冲洗引流双套管1个,腹膜后放置乳胶引流管1根,缝合切口,外接引流装置。术毕即外接庆大霉素生理盐水进行持续冲洗。
1.5 术后处理术后卧床、制动,联合使用广谱抗生素(头孢哌酮及左氧氟沙星),进行营养支持及护肝,监测血常规、ESR、CRP(每3~5 d一次),根据患者的病原菌血培养及药敏试验结果适当调整抗生素方案。患者症状缓解且无反复,ESR及CRP基本恢复至正常则停止冲洗并改为口服抗生素,抗生素使用疗程至少6周。术后卧床6周,期间进行腰背肌及下肢功能锻炼,6周以后佩戴支具下床活动,3个月内仍以卧床为主,定期门诊复查。
1.6 随访及疗效评估记录本组患者手术时间、术中出血量,比较术前及术后各不同随访时间点(1周、3个月、6个月、12个月)的腰痛视觉模拟量表(VAS)评分[8]和Oswestry功能障碍指数(ODI)[9],门诊随访影像学检查包括腰椎正侧位、动力位X线片及腰椎CT,用于评价椎间自发融合及稳定性,实验室检查包括血常规、ESR及CRP,用于判断感染复发情况。
1.7 统计学处理采用SPSS 20.0软件对数据进行统计学分析,计量资料以x±s表示。本组患者术前、术后腰痛VAS评分和ODI的比较采用重复测量资料的方差分析,不同随访时间点ODI之间的多重比较采用Bonferroni t检验,以P < 0.05为差异具有统计学意义。
2 结果本组患者手术时间为70~120(88.3±16.0)min,术中出血量为40~190(97.0±38.9)mL;术后病理检查结果显示为髓核及变性坏死纤维束,伴有急慢性炎性细胞浸润。病原菌培养结果:真菌感染1例(热带假丝酵母菌)、表皮葡萄球菌3例、耐甲氧西林金黄色葡萄球菌(MRSA)1例、混合性细菌感染1例(大肠埃希菌、铜绿假单胞菌及鲍曼不动杆菌),培养阴性4例。术后ESR及CRP均回落,提示炎症得到有效控制。
本组患者随访时间为12~24(19.8±4.9)个月,各不同随访时间点腰痛VAS评分和ODI均较术前降低,差异具有统计学意义(P < 0.05,表 1),所有患者均能恢复至正常生活状态。术后初次门诊随访时所有患者WBC计数、中性粒细胞比例及CRP均处于正常范围,其中2例ESR稍高于临界值,而后续门诊实验室检查结果均正常。本组无手术相关并发症发生。末次随访时,腰椎CT显示病变椎间隙近乎消失,相邻椎体间骨桥形成,其中7例患者出现部分椎体间骨性融合。典型病例影像学资料见图 1。
|
|
表 1 统计数据 Table 1 Statistical data |
|
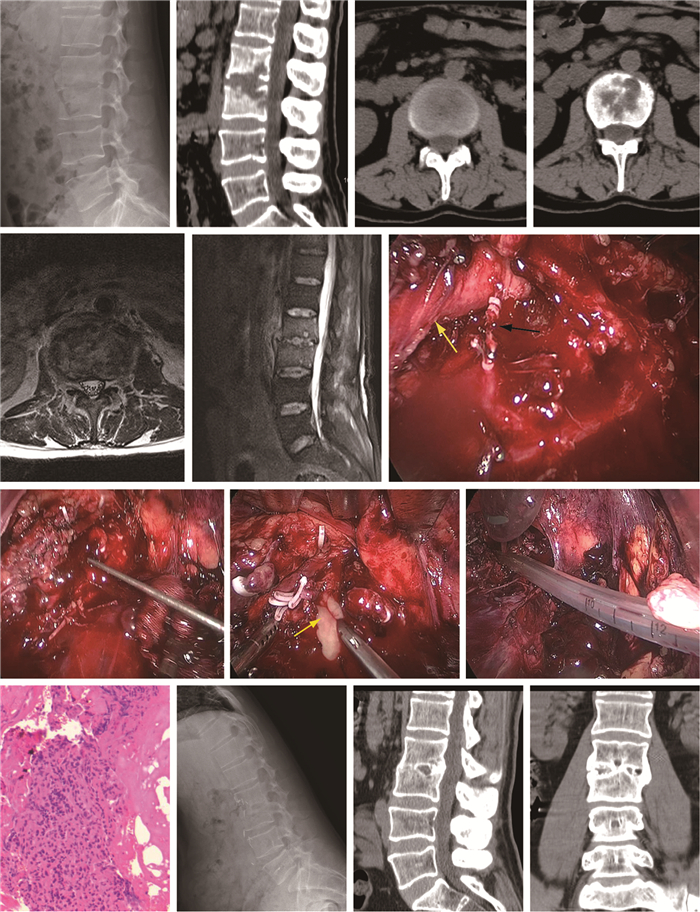
男,35岁,病变节段L2/L3,急性非淋巴细胞白血病M2型(ANLL-M2),化疗后粒细胞减少并发肺部及尿路感染,静脉使用广谱抗生素8周 a,b:术前侧位X线片及矢状位CT示受累椎间隙变窄,终板及椎体骨质侵蚀性破坏,相邻椎体密度增高 c,d:术前横断面CT示椎间盘密度减低,椎体边缘及终板破坏,呈虫蚀样改变 e,f:术前T2加权MRI示病变椎间盘变形,其内出现较低的不均匀混杂信号,相邻椎体呈高信号,椎前软组织肿块形成 g:术中暴露腹主动脉(黄色箭头),结扎并切断节段动脉(黑色箭头) h:清理椎前粘连软组织,于椎间隙内浅置1枚克氏针,透视下确认病变椎间隙 i:切开纤维环,大量脓液涌出(黄色箭头),用髓核钳清理坏死椎间盘及炎性肉芽组织 j:彻底清除病灶后,于椎间隙放置1根冲洗引流双套管进行持续灌洗 k:术中标本病理结果示大量急慢性炎性细胞浸润 l~n:术后24个月CT示原病变椎间隙几乎消失,椎体周围骨桥连接并出现了椎体间骨性融合 Male, 35-year-old, M2 acute non-lymphocytic leukemia (ANLL-M2) complicated with pulmonary and urinary tract infection due to neutropenia after chemotherapy, received intravenous broad-specturm antibiotics for 8 weeks a, b:Preoperative lateral roentgenograph and sagittal CT demonstrating narrowing of affected L2/L3 disc space, erosion of vertebral plates and increase in density of adjacent vertebral bodies c, d:Preoperative transverse CT demonstrating decrease in density of intervertebral disc tissue and erosive bone destruction of vertebral edge and plates e, f:Preoperative T2-weighted MRI demonstrating mixed heterogeneous signal in affected intervertebral disc tissue, and high signal on adjacent vertebral bodies and prevertebral soft tissue mass formation g:Exposing abdominal aorta (yellow arrow), ligating lumbar segmental artery (black arrow) and cutting it off h:Cleaning soft tissue adhension in front of lumbar vertebrae and shallowly putting 1 Kirschner's wire into intervertebral space to confirm lesion segment under fluoroscopy guidance i:After opening fiber ring, a lot of pus (yellow arrow) gushing, then necrotic intervertebral disc and inflammatory granulation tissue are cleaned up j:Putting 1 double catheterization cannula into involved intervertebral space for continuously closing irrigation k:Postoperative pathological examination of specimen reveals acute and chronic inflammation of diseased tissue l-n:Sagittal and coronal CT at postoperative 24 months show that intervertebral space nearly disappear, and there is circumferential bone bridging and evidence of interbody bony fusion 图 1 典型病例影像学资料 Figure 1 Radiologic data of a typical patient |
腰椎椎间盘炎一旦确诊,需根据个体病情选择合适治疗方案,对于病变早期症状轻微、椎体骨质破坏较少、缺乏明确手术指征及存在手术风险的患者可试行非手术治疗[1, 10]。非手术治疗的原则为局部制动与抗感染,由于抗生素难以在椎间盘组织内达到有效抑菌浓度,长疗程的药物治疗通常难以避免。目前抗生素疗程尚无统一标准,多数学者认为6~12周的抗感染疗程必不可少[11-13]。Rutges等[14]系统分析了25项相关研究后指出相比6周的敏感药物治疗,延长疗程并不能显著降低感染的复发率,且长时间应用抗生素易致细菌耐药及多重感染的发生。抗感染治疗理应细化到个体,病原菌的分离培养与药敏试验有助于敏感抗生素的选择,ESR、CRP监测能够反映感染的控制情况以便及时调整后续治疗方案。
腰椎椎间盘炎的确切手术指征包括与影像学相符合的神经受压表现、脊柱稳定性破坏与畸形、抗生素难以控制的败血症及硬膜外脓肿形成[1, 4, 7, 15];而持续无缓解的腰痛亦提示非手术治疗失败,患者常因此痛苦不堪转而选择手术治疗。手术目的在于彻底清除病灶与神经减压,维持或重建脊柱稳定性[1, 7, 15-17]。传统手术分为后路、前路以及联合入路。后路手术适合进行经椎弓根内固定、椎管减压与硬膜外脓肿的清除引流[4, 7, 18],缺点是对位于前方的病变椎间盘及椎体等结构暴露有限而使清除病灶的难度大大增加,同时亦降低了手术安全性。前路手术便于显露位于脊柱前部的病变区域,利于病灶彻底清除和前方植骨内固定的实施,可及时控制感染并缩短卧床制动时间,远期融合率高,较后路手术更为安全可靠,因而被普遍认为是治疗脊柱感染的标准术式[3-4, 7, 18-19],其缺点在于难以进行椎管内探查及减压。前路手术中应用最为广泛的是腹膜后入路,由于不经过腹膜腔,可减少对胃肠道功能的影响以及腹腔脏器损伤,也降低了腹腔内播散感染的概率[3, 7, 18]。腹膜后腹腔镜技术作为一种辅助措施在前路腰椎手术中已得到了一定的应用,有学者利用此技术进行腰椎结核冷脓肿以及非特异感染性腰大肌脓肿的清除和引流,认为相比前路开放手术和CT引导下的介入治疗,腹腔镜技术在充分清除病灶、快速缓解症状的同时兼顾微创的特点,在此类疾病的治疗中具有较大优势[20-23]。
对于脊柱感染的手术治疗,由减压和病灶清除造成的脊柱完整性缺失常需通过植骨内固定进行重建。目前对术中金属内置物的应用存在争议,金属内固定材料作为异物被置入,本身可能引起病原菌的粘附并形成生物包膜,使抗生素难以发挥作用而成为感染复发的潜在因素[4, 24]。近年来,大量相关报道倾向于使用金属内置物治疗脊柱感染,Rayes等[25]对相关文献进行系统综述,发现脊柱感染患者植骨内固定术后感染复发率为1.74%(共689例手术患者),与非感染脊柱疾病行内固定融合术的患者(术后感染发生率2%~9%)无明显差异。De La Garza-Ramos等[26]回顾2003—2013年共26篇相关文献(共931例内固定融合手术患者),发现感染复发率为1.6%,与Rayes等[25]报道相近;但总体术后感染(深部感染复发+浅表切口感染)发生率达6.3%,约为同期因退变性疾病行内固定融合术患者的3倍。因此认为使用内固定治疗脊柱感染时应当严格把握适应证,权衡利弊。
本研究中的病例均未行植骨内固定,仅利用腹腔镜进行单纯病灶清除和置管冲洗,这是本研究组综合考虑所制定的治疗方案。以收治的急性白血病患者为例,由于患者化疗后伴粒细胞减少,抗感染能力弱,而位于深部椎间隙的感染病灶,即便彻底清创亦难以确保无病原菌残留,因此内固定置入将使术后感染复发的风险大大增加;其次病变仅累及单个节段,椎体骨质破坏尚未导致明显腰椎不稳与畸形。Guerado等[7]认为单节段腰椎椎间盘炎手术治疗可不使用内固定,Shepard等[27]提出有限的椎间隙病灶清除无需进行植骨内固定。对一般情况不佳或有严重并存疾病者,时间短、出血少、恢复快的微创手术无疑是较为理想的治疗方式。根据围手术期观察以及术后随访,10例患者均达到了预期的手术效果。因此腹膜后入路腹腔镜下病灶清除及冲洗引流,可使炎症迅速得到控制,且术中出血量少、手术并发症发生率低,适用于无明显腰椎不稳及畸形的单节段腰椎椎间盘炎(如L1~L5)的治疗。
尽管腹腔镜技术较开放手术拥有更多优势,但操作难度大、学习周期长,要求术者具有熟练的解剖基础及开放手术经验,否则会因操作不当而增加输尿管、腹膜后血管神经损伤等并发症的发生率。而实际术中,由于炎症波及而产生的椎前组织粘连常增加显露难度,不慎误切节段动脉会引起大量出血,由于镜下止血难度大,因此必须谨慎操作,若节段动脉走行影响手术操作,可于近腹主动脉侧(远离椎间孔)将其结扎切断,既不影响手术操作也使脊髓血供得以保留。本回顾性研究的缺陷在于样本量小,随访时间短,今后尚需进一步收集资料,以全面而客观地评估腹膜后腹腔镜技术的疗效。
| [1] | Zarghooni K, Röllinghoff M, Sobottke R, et al. Treatment of spondylodiscitis[J]. Int Orthop, 2012, 36(2): 405–411. DOI:10.1007/s00264-011-1425-1 |
| [2] | Gouliouris T, Aliyu SH, Brown NM. Spondylodiscitis: update on diagnosis and management[J]. J Antimicrob Chemother, 2010, 65(Suppl 3): ii 11–iii 24. |
| [3] | Cheung WY, Luk KD. Pyogenic spondylitis[J]. Int Orthop, 2012, 36(2): 397–404. DOI:10.1007/s00264-011-1384-6 |
| [4] | Chen WH, Jiang LS, Dai LY. Surgical treatment of pyogenic vertebral osteomyelitis with spinal instrumentation[J]. Eur Spine J, 2007, 16(9): 1307–1316. DOI:10.1007/s00586-006-0251-4 |
| [5] | Hey HW, Hwee Weng Dennis H, Chuen Seng T, et al. Spinal implants can be inserted in patients with deep spine infection-results from a large cohort study[J]. Spine (Phila Pa 1976), 2016. [Epub ahead of print] |
| [6] | Kasliwal MK, Tan LA, Traynelis VC. Infection with spinal instrumentation: review of pathogenesis, diagnosis, prevention, and management[J]. Surg Neurol Int, 2013, 4((Suppl 5): S392–403. |
| [7] | Guerado E, Cerván AM. Surgical t reatment of spondylodiscitis. An update[J]. Int Orthop, 2012, 36(2): 413–420. DOI:10.1007/s00264-011-1441-1 |
| [8] | Huskisson EC. Measurement of pain[J]. Lancet, 1974, 2(7889): 1127–1131. |
| [9] | Chow JH, Chan CC. Validation of the Chinese version of the Oswestry Disability Index[J]. Work, 2005, 25(4): 307–314. |
| [10] | Sobottke R, Röllinghoff M, Zarghooni K, et al. Spondylodiscitis in the elderly patient: clinical mid-term results and quality of life[J]. Arch Orthop Trauma Surg, 2010, 130(9): 1083–1091. DOI:10.1007/s00402-009-0972-z |
| [11] | Roblot F, Besnier JM, Juhel L, et al. Optimal duration of antibiotic therapy in vertebral osteomyelitis[J]. Semin Arthritis Rheum, 2007, 36(5): 269–277. DOI:10.1016/j.semarthrit.2006.09.004 |
| [12] | Akiyama T, Chikuda H, Yasunaga H, et al. Incidence and risk factors for mortality of vertebral osteomyelitis: a retrospective analysis using the Japanese diagnosis procedure combination database[J]. BMJ Open, 2013, 3(3): e002412.. DOI:10.1136/bmjopen-2012-002412 |
| [13] | Zimmerli W. Clinical practice. Vertebral osteomyelitis[J]. N Engl J Med, 2010, 362(11): 1022–1029. DOI:10.1056/NEJMcp0910753 |
| [14] | Rutges JP, Kempen DH, van Dijk M, et al. Outcome of conservative and surgical treatment of pyogenic spondylodiscitis: a systematic literature review[J]. Eur Spine J, 2016, 25(4): 983–999. DOI:10.1007/s00586-015-4318-y |
| [15] | Homagk L, Homagk N, Klauss JR, et al. Spondylodiscitis severity code: scoring system for the classification and treatment of non-specific spondylodiscitis[J]. Eur Spine J, 2016, 25(4): 1012–1020. DOI:10.1007/s00586-015-3936-8 |
| [16] | Ruf M, Stoltze D, Merk HR, et al. Treatment of vertebral osteomyelitis by radical debridement and stabilization using titanium mesh cages[J]. Spine (Phila Pa 1976), 2007, 32(9): E275–280. DOI:10.1097/01.brs.0000261034.83395.7f |
| [17] | Quiñones-Hinojosa A, Jun P, Jacobs R, et al. General principles in the medical and surgical management of spinal infections: a multidisciplinary approach[J]. Neurosurg Focus, 2004, 17(6): E1. |
| [18] | Mavrogenis AF, Igoumenou V, Tsiavos K, et al. When and how to operate on spondylodiscitis: a report of 13 patients[J]. Eur J Orthop Surg Traumatol, 2016, 26(1): 31–40. DOI:10.1007/s00590-015-1674-6 |
| [19] | Yaldz C, Özdemir N, Yaman O, et al. A retrospective study of 39 patients treated with anterior approach of thoracic and lumbar spondylodiscitis: clinical manifestations, anterior surgical treatment, and outcome[J]. Medicine (Baltimore), 2015, 94(47): e2110. DOI:10.1097/MD.0000000000002110 |
| [20] | Katara AN, Shah RS, Bhandarkar DS, et al. Retroperitoneoscopic drainage of a psoas abscess[J]. J Pediatr Surg, 2004, 39(9): e4–5. DOI:10.1016/j.jpedsurg.2004.05.033 |
| [21] | Büyükbebe c i O, Seçkiner I, Karslı B, et al. Retroperitoneoscopic drainage of complicated psoas abscesses in patients with tuberculous lumbar spondylitis[J]. Eur Spine J, 2012, 21(3): 470–473. DOI:10.1007/s00586-011-2049-2 |
| [22] | Kodama K, Takase Y, Motoi I, et al. Retroperitoneoscopic drainage of bilateral psoas abscesses under intraoperative laparoscopic ultrasound guidance[J]. Asian J Endosc Surg, 2014, 7(2): 179–181. DOI:10.1111/ases.2014.7.issue-2 |
| [23] | 唐勇, 沈慧勇, 高梁斌, 等. 腹膜后入路腹腔镜下手术治疗腰椎结核[J]. 中国脊柱脊髓杂志, 2012, 22(9): 775–778. |
| [24] | Brady RA, Leid JG, Calhoun JH, et al. Osteomyelitis and the role of biofilms in chronic infection[J]. FEMS Immunol Med Microbiol, 2008, 52(1): 13–22. DOI:10.1111/j.1574-695X.2007.00357.x |
| [25] | Rayes M, Colen CB, Bahgat DA, et al. Safety of instrumentation in patients with spinal infection[J]. J Neurosurg Spine, 2010, 12(6): 647–659. DOI:10.3171/2009.12.SPINE09428 |
| [26] | De La Garza-Ramos R, Bydon M, Macki M, et al. Instrumented fusion in the setting of primary spinal infection[J]. J Neurosurg Sci, 2017, 61(1): 64–76. |
| [27] | Shepard M, Safain M, Burke SM, et al. Lateral retroperitoneal transpsoas approach to the lumbar spine for the treatment of spondylodiscitis[J]. Minim Invasive Ther Allied Technol, 2014, 23(5): 309–312. DOI:10.3109/13645706.2014.908924 |
 2017, Vol.15
2017, Vol.15  Issue(2): 71-76
Issue(2): 71-76


