2. 中国人民解放军第307医院骨科, 北京 100071;
3. 首都医科大学附属北京友谊医院统计室, 北京 100050
2. Department of Orthopaedics, 307th Hospital of Chinese PLA, Beijing 100071, China;
3. Department of Statistics, Beijing Friendship Hospital, Capital Medical University, Beijing 100050, China
乳腺癌是成年女性最常见的恶性肿瘤,约70%的乳腺癌患者会出现骨转移,而脊柱是骨转移中最常见的部位[1-2]。有报道称恶性肿瘤脊柱转移存在脊髓压迫(SCC)的患者中位生存期为2~6个月[3]。随着化疗方案的不断优化以及靶向药物、内分泌治疗的不断进步,乳腺癌患者生存期大大延长,很多患者甚至在肿瘤多发转移后依然可以带瘤生存数年。但是,脊柱转移瘤患者发生骨相关事件(SREs),如骨痛、SCC、病理性骨折、高钙血症等的风险大大增加。患者早期可能存在背部局部疼痛,病情进展可出现四肢放射痛、四肢无力麻木、括约肌功能障碍等神经功能损害,严重者可出现完全性瘫痪,影响生活质量。患者一旦出现完全性瘫痪,其运动功能很难完全恢复[4-5]。早期诊断、及时干预可以延缓或改善神经功能损伤。
1 资料和方法 1.1 纳入及排除标准纳入标准:①乳腺癌确诊且术后病理证实转移病灶符合乳腺来源;②影像学证实存在病理性骨破坏,且主要转移病灶位于胸椎或腰椎;③存在下列一项或多项临床表现者,胸椎或腰椎局部疼痛视觉模拟量表(VAS)评分[6] > 4分、感觉或运动功能损伤并进行性加重、括约肌功能损伤;④脊柱多发转移瘤不宜行全脊椎整块切除术。排除标准:①脊髓内转移;②脊柱转移瘤患椎已行手术或放射治疗。
1.2 一般资料回顾性分析2010年1月—2015年5月在解放军第307医院骨科接受手术治疗(后路减压内固定术和经皮椎体成形术)的乳腺癌脊柱转移瘤患者的临床资料。符合纳入标准且临床资料完善的患者共65例,均为女性,年龄38~74岁,平均59岁。入院时60例患者既往有乳腺癌病史,其中38例曾行乳腺癌根治术,46例术前1年内接受过系统内科治疗(化疗和/或靶向治疗和/或内分泌治疗);5例为乳腺癌首次确诊患者,以脊柱转移瘤相关症状为主要就诊原因入院。41例存在重要脏器(脑、肺、肝等)转移,24例无内脏转移。单椎体受累15例,双椎体受累21例,多椎体(≥3个)受累29例。累及胸椎38例,腰椎14例,胸腰椎13例。
1.3 治疗方法患者手术方案及术后辅助放疗计划均由骨科、乳腺肿瘤科、放疗科多学科会诊联合制定。手术方式包括后路椎板切除椎管减压肿瘤切除钉棒系统内固定术和经皮椎体成形术。29例SCC患者影像学检查证实转移瘤硬膜外压迫脊髓,且存在相应的临床症状,采用后路减压内固定术治疗,术中根据出血情况、肿瘤位置等实际情况尽可能刮除肿瘤病灶。36例无SCC患者影像学检查证实椎体病理性压缩骨折不伴有SCC;潜在性脊柱不稳,脊柱肿瘤不稳定评分(SINS)[7] > 7分;伴有中或重度疼痛,VAS评分 > 4分,采用经皮椎体成形术治疗。
54例患者在术后接受了系统的内科治疗(伊立替康+卡培他滨5例、多西他赛+奥沙利铂7例、AC方案13例、AC-T方案11例、TC方案10例;曲妥珠单抗联合化疗治疗HER-2阳性患者24例,贝伐单抗联合化疗治疗HER-2阴性患者19例;23例激素受体阳性患者联合了他莫西芬/芳香化酶抑制剂治疗)。27例患者由于严重肾功能不全或因患者拒绝而未用唑来膦酸治疗,其余患者均接受了唑来膦酸治疗(4 mg/4周)。43例患者术后进行了患椎辅助放疗(调强放疗26例,立体定向放疗17例)。
1.4 数据采集及统计学处理评价患者VAS评分、体力状态美国东部肿瘤协作组(ECOG)评分[8]、神经功能Frankel分级[9]改善情况,探讨手术方式、系统内科治疗、患椎辅助放疗、术前内脏转移、术后运动功能状态(Frankel分级)、术前体力状态(ECOG评分)和受累椎体数目对术后生存期的影响。采用SPSS 18.0软件对数据进行统计学分析。手术前后VAS评分比较采用配对样本t检验。手术前后ECOG评分及神经功能Frankel分级的比较采用配对资料的秩和检验。生存预后分析采用Kaplan-Meier和Cox比例风险模型法。以P < 0.05为差异有统计学意义。
2 结果术前2周ECOG评分:0分2例,1分18例,2分31例,3分13例,4分1例。术后4周ECOG评分:0分3例,1分23例,2分28例,3分10例,4分1例,手术前后体力状态差异无统计学意义(P > 0.05);但SCC组患者手术前后ECOG评分差异有统计学意义(表 1,P < 0.05)。SCC组患者VAS评分由术前(5.7±1.4)分降至术后2周(2.0±0.9)分,末次随访时为(2.5±1.2)分;疼痛缓解,与术前相比差异有统计学意义(P < 0.05)。NSCC组患者VAS评分由术前(6.2±1.5)分降至术后2周(2.1±1.2)分,末次随访时为(2.0±1.4)分;疼痛缓解,与术前相比差异有统计学意义(P < 0.05)。手术前后两组患者疼痛程度差异无统计学意义(P > 0.05)。值得注意的是NSCC患者患椎疼痛在24 h内即可得到明显缓解,这可能受益于微创手术对软组织损伤较小。
|
|
表 1 手术前后ECOG评分 Table 1 Pre-and post-operative ECOG score |
SCC组中18例患者术前无行走能力(Frankel分级为C或B级),11例患者术前有行走能力(Frankel分级为D级);术前无行走能力的18例患者中11例(61%)术后重新获得行走能力。术后4周15例(52%)神经功能Frankel分级获得改善,14例(48%)维持不变(表 2)。NSCC组34例患者术后4周Frankel分级无变化,2例患者术后4周神经功能恶化,E级进展为D级。
|
|
表 2 SCC患者手术前后Frankel分级 Table 2 Pre-and post-operative Frankel grade of SCC patients |
所有患者随访0~44.6个月,平均20.3个月;49例死亡,16例仍存活,中位生存期19.2个月(95%可信区间17.7~22.8个月)。单变量生存分析(Kaplan-Meier法)结果显示系统内科治疗、受累椎体数目、术前内脏转移、术前ECOG评分、术后运动功能对术后生存期有显著影响(log-rank检验,P < 0.05,图 1)。上述因素纳入Cox比例风险模型进行多变量分析,结果显示系统内科治疗、术前内脏转移、术前ECOG评分是影响患者术后生存期的重要预后因素(表 3)。
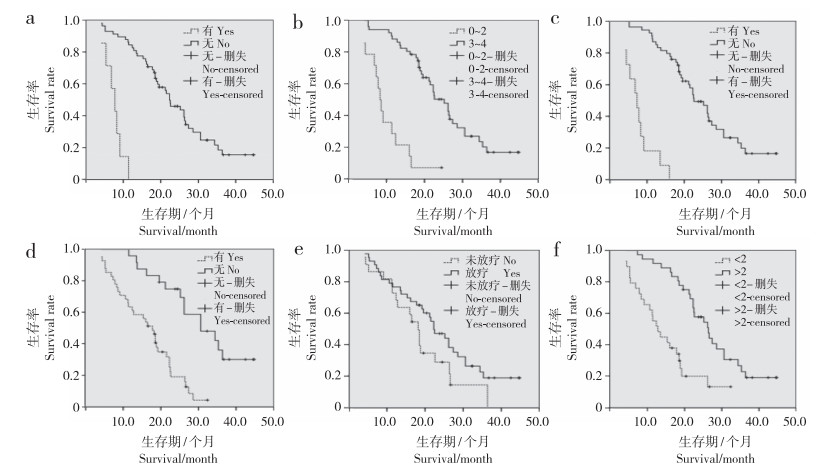
|
a:术后运动功能(P < 0.05) b:术前ECOG评分(P < 0.05) c:系统内科治疗(P < 0.05) d:术前内脏转移(P < 0.05) e:术后患椎放疗(P > 0.05) f:受累椎体数目(P < 0.05) a:Postoperative ambulatory status (P < 0.05) b:Preoperative ECOG (P < 0.05) c:Standard medical treatment (P < 0.05) d:Preoperative visceral metastases (P < 0.05) e:Postoperative radiation therapy (P > 0.05) f:Number of invaded vertebrae (P < 0.05) 图 1 各预后因素与生存期相关性 Figure 1 Correlation between prognostic factors and survival |
|
|
表 3 Cox比例风险模型的生存分析 Table 3 Survival analysis by Cox proportional hazards models |
乳腺癌脊柱转移瘤的外科治疗主要目的是缓解疼痛,恢复脊柱稳定性,维持或改善神经功能,提高患者生活质量,延长生存期。有研究显示全脊椎整块切除可以实现转移瘤完全切除,延长生存期,但手术难度大,术后并发症发生率高,且手术适应证较窄[10-11]。目前脊柱转移瘤的外科治疗大多数是姑息性手术,可减轻患者疼痛、维持或改善神经功能、提高患者生活质量,对生存期无明显改善。随着精准医学的提出,目前脊柱转移瘤的治疗正向着个体化、多学科联合、精准治疗的方向转变。适当时机进行适当的外科干预不仅可以改善患者生活质量,而且便于内科化疗和放疗的实施[12]。
2005年Patchell等[13]进行了一项前瞻性对照试验,结果表明减压手术联合术后放疗相对于单纯放疗在维持或改善患者步行功能方面有明显优势。目前后路椎板切除减压内固定术依然是治疗脊柱转移瘤脊髓压迫症(MSCC)的标准术式,大量研究证实它可以有效缓解疼痛,维持或改善神经功能[14-17]。本研究中SCC组61%患者术后重新获得行走能力,52%患者术后神经功能改善,这与国内外报道(20%~78%)相接近[13, 18]。韩秀鑫等[19]的研究指出减压内固定术后患者Frankel分级改善率达57%。Chong等[20]在一项回顾性分析中纳入105例接受减压术的MSCC患者,术后Frankel分级改善率为20%。Kato等[15]在一项纳入135例样本的回顾性分析中指出减压内固定术后患者步行功能改善率达50%。
脊柱转移瘤骨破坏造成的椎体病理性压缩骨折也十分常见[21]。对于病理性骨折引起的机械性疼痛不伴有SCC的患者,经皮椎体成形术是首选术式[22]。此外,对于潜在性脊柱不稳(SINS评分 > 7分)且伴有疼痛症状的患者,经皮椎体成形术可以缓解疼痛,预防压缩性骨折的发生[23]。当然无论采用何种手术方式,其主要目的都是提高患者生活质量。本研究中65例患者术后疼痛均获得改善,开放性的后路减压内固定术与经皮椎体成形术相比,在疼痛缓解方面差异无统计学意义。但经皮椎体成形术对于疼痛的改善是“立竿见影”的,也便于患者术后尽早接受放化疗。近期一项研究显示经皮椎体成形术患者术前VAS评分为(7.4±1.1)分,术后3 d为(2.5±0.9)分,术后1个月为(2.1±1.1)分,术后1年为(1.8±0.9分)[24]。
对于患者预后认识不足,可能造成“过度治疗”或“治疗不足”。明确脊柱转移瘤相关预后预测因素可以帮助临床医生更好地判断患者预后转归,制定个体化的治疗方案。目前认为原发肿瘤类型、有无内脏转移、体力状态、神经功能状态等因素与预后相关,也有报道显示年龄、辅助放疗和化疗、术后瘫痪状态也是术后生存期的重要影响因素[25-30]。本研究对手术方式、有无系统内科治疗、患椎放疗、术前内脏转移、术后运动功能状态(Frankel分级)、术前体力状态(ECOG评分)和受累椎体数目等7个因素进行单变量及多变量分析,结果显示系统内科治疗、术前内脏转移、术前体力状态是影响患者术后生存期的重要预后因素。目前临床使用较多的预后评分系统有Tokuhashi评分和Tomita评分,但这些评分系统并不是针对特定的肿瘤而建立的,近年来研究显示其准确率逐年下降[30-31],这可能与早期诊断对症支持手段的进步以及靶向药物的增多有关。通过现有的预后评分系统及多种预后因素的综合考虑可以尽可能准确地判断患者术后功能及生存转归情况,有助于临床医生,尤其是外科医生决定手术与否及手术时机和手术方式的选择。
总之,对于预期生存期 > 6个月,可耐受开放性手术的SCC患者,后路减压内固定术可以有效改善或延缓SCC引起的神经功能障碍。对于病理性骨折或预期寿命较短的转移瘤患者经皮椎体成形术可有效减轻患椎疼痛。无论采用何种手术方式,都建议进行规范系统的内科治疗和术后患椎辅助放疗。系统内科治疗、术前内脏转移情况、术前体力状态是乳腺癌脊柱转移瘤患者术后生存期的重要影响因素,可以为临床医生提供一定的参考。受限于回顾性分析和样本量较小,本研究结果仍需要前瞻性大样本对照研究进一步证实。
| [1] | Ortiz Gómez JA. The incidence of vertebral body meta stases[J]. Int Orthop, 1995, 19(5): 309–311. |
| [2] | Kaloostian PE, Yurter A, Zadnik PL, et al. Current paradigms for metastatic spinal disease: an evidencebased review[J]. Ann Surg Oncol, 2014, 21(1): 248–262. DOI:10.1245/s10434-013-3324-8 |
| [3] | Moon KY, Chung CK, Jahng TA, et al. Postoperative survival and ambulatory outcome in metastatic spinal tumors: prognostic factor analysis[J]. J Korean Neurosurg Soc, 2011, 50(3): 216–223. DOI:10.3340/jkns.2011.50.3.216 |
| [4] | 刘蜀彬, 刘耀升, 李鼎峰, 等. 转移瘤脊髓压迫症运动功能损害与影像学特征的相关性[J]. 中华医学杂志, 2010, 90(23): 1606–1608. DOI:10.3760/cma.j.issn.0376-2491.2010.23.006 |
| [5] | Lei M, Liu Y, Tang C, et al. Prediction of survival prognosis after surgery in patients with symptomatic metastatic spinal cord compression from non-small cell lung cancer[J]. BMC Cancer, 2015, 15: 853. DOI:10.1186/s12885-015-1852-2 |
| [6] | Huskisson EC. Measurement of pain[J]. Lancet, 1974, 2(7889): 1127–1131. |
| [7] | Fisher CG, DiPaola CP, Ryken TC, et al. A novel classification system for spinal instability in neoplastic disease: an evidence-based approach and expert consensus from the Spine Oncology Study Group[J]. Spine (Phila Pa 1976), 2010, 35(22): E1221–1229. DOI:10.1097/BRS.0b013e3181e16ae2 |
| [8] | Shvarts O, Lam JS, Kim HL, et al. Eastern cooperative oncology group performance status predicts bone metastasis in patients presenting with renal cell carcinoma: implication for preoperative bone scans[J]. J Urol, 2004, 172(3): 867–870. DOI:10.1097/01.ju.0000135803.91207.b0 |
| [9] | Frankel HL, Hancock DO, Hyslop G, et al. The value of postural reduction in the initial management of closed injuries of the spine with paraplegia and tetraplegia. I[J]. Paraplegia, 1969, 7(3): 179–192. DOI:10.1038/sc.1969.30 |
| [10] | Salame K, Regev G, Keynan O, et al. Total en bloc spondylectomy for vertebral tumors[J]. Isr Med Assoc J, 2015, 17(1): 37–41. |
| [11] | Li H, Gasbarrini A, Cappuccio M, et al. Outcome of excisional surgeries for the patients with spinal metastases[J]. Eur Spine J, 2009, 18(10): 1423–1430. DOI:10.1007/s00586-009-1111-9 |
| [12] | 雷明星, 刘耀升, 刘蜀彬. 骨转移瘤系统性分子靶向治疗靶点与药理学制剂研究[J]. 中华骨科杂志, 2016, 36(1): 58–64. |
| [13] | Patchell RA, Tibbs PA, Regine WF, et al. Direct decompressive surgical resection in the treatment of spinal cord compression caused by metastatic cancer: a randomised trial[J]. Lancet, 2005, 366(9486): 643–648. DOI:10.1016/S0140-6736(05)66954-1 |
| [14] | Walter J, Reichart R, Waschke A, et al. Palliative cons-iderations in the surgical treatment of spinal metastases: evaluation of posterolateral decompression combined with posterior instrumentation[J]. J Cancer Res Clin Oncol, 2012, 138(2): 301–310. DOI:10.1007/s00432-011-1100-3 |
| [15] | Kato S, Hozumi T, Takeshita K, et al. Neurological recovery after posterior decompression surgery for anterior dural compression in paralytic spinal metastasis[J]. Arch Orthop Trauma Surg, 2012, 132(6): 765–771. DOI:10.1007/s00402-012-1475-x |
| [16] | Crnalic S, Hildingsson C, Wikström P, et al. Outcome after surgery for metastatic spinal cord compression in 54 patients with prostate cancer[J]. Acta Orthop, 2012, 83(1): 80–86. DOI:10.3109/17453674.2011.590761 |
| [17] | Lei M, Liu Y, Yan L, et al. Posterior decompression and spine stabilization for metastatic spinal cord compression in the cervical spine. A matched pair analysis[J]. Eur J Surg Oncol, 2015, 41(12): 1691–1698. DOI:10.1016/j.ejso.2015.09.025 |
| [18] | Park JH, Jeon SR. Pre-and postoperative lower extremity motor power and ambulatory status of patients with spinal cord compression due to a metastatic spinal tumor[J]. Spine (Phila Pa 1976), 2013, 38(13): E798–E802. DOI:10.1097/BRS.0b013e3182927559 |
| [19] | 韩秀鑫, 王国文, 张超, 等. 121例脊柱转移瘤手术治疗的疗效分析[J]. 中华骨科杂志, 2014, 34(11): 1127–1133. DOI:10.3760/cma.j.issn.0253-2352.2014.11.007 |
| [20] | Chong S, Shin SH, Yoo H, et al. Single-stage posterior decompression and stabilization for metastasis of the thoracic spine: prognostic factors for functional outcome and patients' survival[J]. Spine J, 2012, 12(12): 1083–1092. DOI:10.1016/j.spinee.2012.10.015 |
| [21] | Roodman GD. Genes associate with abnormal bone cell activity in bone metastasis[J]. Cancer Metastasis Rev, 2012, 31(3-4): 569–578. DOI:10.1007/s10555-012-9372-x |
| [22] | Zairi F, Marinho P, Bouras A, et al. Recent concepts in the management of thoracolumbar spine metastasis[J]. J Neurosurg Sci, 2013, 57(1): 45–54. |
| [23] | Eleraky M, Papanastassiou I, Setzer M, et al. Balloon kyphoplasty in the treatment of metastatic tumors of the upper thoracic spine[J]. J Neurosurg Spine, 2011, 14(3): 372–376. DOI:10.3171/2010.11.SPINE09909 |
| [24] | Tian QH, Sun XQ, Lu YY, et al. Percutaneous vertebroplasty for palliative treatment of painful osteoblastic spinal metastases: a single-center experience[J]. J Vasc Interv Radiol, 2016, 27(9): 1420–1424. DOI:10.1016/j.jvir.2016.04.033 |
| [25] | Corcos G, Dbjay J, Mastier C, et al. Cement leakage in percutaneous vertebroplasty for spinal metastases: a retrospective evaluation ofincidence and risk factors[J]. Spine (Phila Pa 1976), 2014, 39(5): E332–338. DOI:10.1097/BRS.0000000000000134 |
| [26] | Tokuhashi Y, Ajiro Y, Umezawa N. Outcome of treatment for spinal metastases using scoring system for preoperative evaluation of prognosis[J]. Spine (Phila Pa 1976), 2009, 34(1): 69–73. DOI:10.1097/BRS.0b013e3181913f19 |
| [27] | Eap C, Tardieux E, Goasgen O, et al. Tokuhashi score and other prognostic factors in 260 patients with surgery for vertebral metastases[J]. Orthop Traumatol Surg Res, 2015, 101(4): 483–488. DOI:10.1016/j.otsr.2015.03.007 |
| [28] | Tomita K, Kawahara N, Murakami H, et al. Total en bloc spondylectomy for spinal tumors: improvement of the technique and its associated basic background[J]. J Orthop Sci, 2006, 11(1): 3–12. DOI:10.1007/s00776-005-0964-y |
| [29] | Hessler C, Vettorazzi E, Madert J, et al. Actual and predicted survival time of patients with spinal metastases of lung cancer: evaluation of the robustness of the Tokuhashi score[J]. Spine (Phila Pa 1976), 2011, 36(12): 983–989. DOI:10.1097/BRS.0b013e3181e8f7f8 |
| [30] | Park S, Lee C, Chung S, et al. How accurately can Tokuhashi score system predict survival in the current practice for spinal metastases?: prospective analysis of 145 consecutive patients between 2007 and 2013[J]. J Spinal Disord Tech, 2015, 28(4): E219–224. DOI:10.1097/BSD.0000000000000225 |
 2017, Vol.15
2017, Vol.15  Issue(2): 111-116
Issue(2): 111-116


