2. 同济大学附属第十人民医院脊柱外科, 上海 200072
2. Department of Spinal Surgery, Shanghai 10 th People's Hospital, Tongji University, Shanghai 200072, China
目前,经椎间孔腰椎椎间融合术(TLIF)是治疗腰椎退变性疾病的有效方法,但术后导致相邻节段退变(ASD)的报道屡见不鲜,而相邻节段腰椎椎间盘突出症是TLIF术后ASD的常见类型,往往需要手术治疗[1-4]。对于TLIF术后出现相邻节段腰椎椎间盘突出的患者,第一次全椎板切除术导致硬膜外瘢痕组织的形成,如再次行TLIF时需要处理硬膜外周围的瘢痕组织,往往会引起硬膜破裂,导致脑脊液漏等并发症[5-8]。此外,术中还需要延长内固定装置,对患者造成的创伤较大,内固定术后对邻近节段也会产生一定的影响,因此限制了该术式的应用。近年来经椎间孔入路经皮内窥镜下椎间盘切除术(PETD)得到了快速的发展,因其具有出血少、对肌肉及脊柱稳定性破坏小、创伤小及恢复快等优点,已广泛应用于腰椎椎间盘突出症的治疗。目前对TLIF术后相邻节段腰椎椎间盘突出症的治疗方案仍存在争议,本研究回顾性分析了PETD治疗TLIF术后相邻节段腰椎椎间盘突出症的临床疗效,希望为同道针对不同患者选择最佳、个性化的手术方案提供参考。
1 资料与方法1.1 一般资料病例纳入标准:① 患者均有不同程度的腰痛及下肢疼痛、麻木等症状;② MRI及CT检查提示腰椎内固定术后相邻节段软性椎间盘突出;③ 症状持续 > 3个月,经非手术治疗无效或效果差;④ 患者第一次手术均为TLIF。排除标准:① 合并其他节段椎间盘突出;② 合并腰椎椎管狭窄症、腰椎滑脱症、腰椎肿瘤、感染或畸形;③ 突出椎间盘严重钙化;④ 多节段腰椎椎间盘突出症;⑤ 腰椎动力位X线检查提示腰椎不稳。本研究纳入2012年12月—2014年12月在同济大学附属第十人民医院脊柱外科行PETD治疗的TLIF术后相邻节段腰椎椎间盘突出的患者28例,男12例,女16例;年龄(62.9±7.5)岁;其中L2/L3 2例,L3/L4 8例,L4/L5 13例,L5/S1 5例。所有患者术前均接受腰椎正侧位及动力位X线、CT、MRI检查。CT及MRI检查示腰椎内固定术后相邻节段腰椎椎间盘突出,神经受压。
1.2 手术方法患者俯卧于Wilson腰架上,腰部稍后凸,使椎间隙后侧充分张开,扩大Kambin穿刺三角区的面积。采用自主研发的体表定位器进行术前定位,于腰椎正位体表标记出棘突、椎弓根、关节突、椎间隙及突出椎间盘的位置;侧位体表标记出椎间孔位置及椎间隙。确定穿刺点距棘突中线的距离,一般L2/L3节段为7~9 cm,L3/L4节段为8~10 cm,L4/L5节段为11~14 cm,L5/S1节段为12~16 cm,结合患者的体型进行适当的调整,确定手术穿刺路径。背部手术视野常规消毒铺巾,采用1%利多卡因对穿刺路径进行局部浸润麻醉,在G形臂X线机正侧位透视下,用18G的穿刺针穿刺至椎间孔附近。正位X线透视确认位置后,用1%利多卡因对椎间孔附近进行局部麻醉。沿穿刺针置入导丝,以导丝为中心做0.8 cm长的皮肤切口。沿导丝依次放入导杆套筒扩张软组织,对于部分椎间孔较小的患者,往往需要行椎间孔成形术。取出软组织扩张套筒,沿导丝置入TOM针,TOM针定位成功后,沿导丝逐级置入骨钻磨除关节突骨质,扩大椎间孔的直径。一般按直径4.5、6.0、7.0和8.0 mm逐级递增,在椎管侧隐窝或椎间孔狭窄明显的情况下,可磨扩至9.0 mm。椎间孔成形术后沿导丝置入导杆,然后置入工作通道,透视确定工作通道的位置:正位处于髓核突出位置,侧位工作通道尖端位于椎体后缘连线上。镜下咬除突出的髓核组织,探查神经根管,应用双极射频进行局部止血、纤维环成形。术中镜下见硬膜外脂肪可随水流自由搏动,说明神经根减压充分,取出工作通道后缝合切口。
1.3 评估指标及统计学处理记录手术时间、术中出血量、住院天数。采用视觉疼痛模拟量表(VAS)[9]评分评估患者腰腿痛情况,采用Oswestry功能障碍指数(ODI)[10]对患者的日常生活能力进行评估。分别记录患者术前、术后3个月、术后12个月、末次随访时腰部和下肢VAS评分及ODI。末次随访时采用MacNab标准[11]对患者的临床疗效进行评估。
原始数据由2名骨科医生分别进行独立录入并校对。采用SPSS 20.0软件对数据进行统计学分析,以P < 0.05为差异有统计学意义。根据数据分布特点和研究目的,主要进行以下统计。① 描述性统计:对于连续性数据,首先采用单样本Kolmogorov-Smirnov方法检验数据的正态性,以x±s(正态分布)或m0.5±Qd(偏态分布)描述;对于分类数据,采用频数(n)或百分比(%)描述。② 差异比较:组间差异采用独立样本t检验、单因素方差分析(one-way ANOVA)、非参数Mann-Whitney U检验或χ2检验或Fisher精确概率法;组内差异即基线-随访各指标的纵向变化,采用配对t检验。
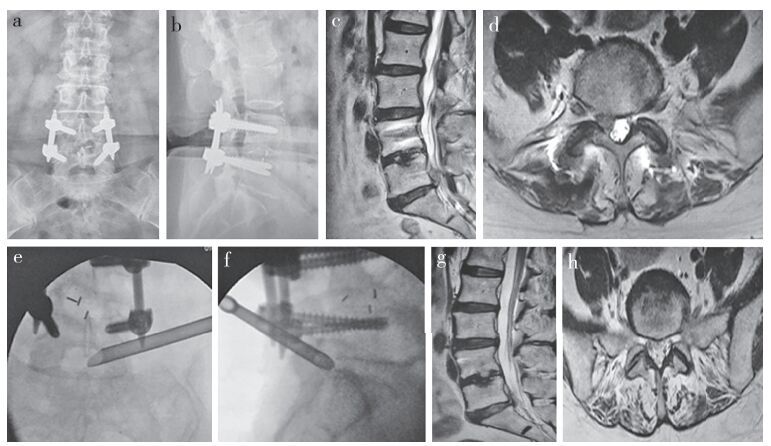
2 结果所有患者在随访过程中无缺失,随访(25.1±3.4)个月,手术时间为(74.0±8.8)min,手术出血量为(32.6±6.8)mL,住院天数为(2.68±1.06)d。术后3个月、术后12个月、末次随访时腰痛和下肢痛VAS评分及ODI与术前相比均有所改善,差异均有统计学意义(P < 0.05,表 1)。根据MacNab标准,末次随访时患者临床疗效优良率为89.3%:其中优14例,良11例,可2例,差1例。术中出现硬膜破裂、脑脊液漏1例,未作特殊处理,伤口愈合良好,无感染。术后出现感觉迟钝1例,经脱水、营养神经治疗后症状缓解;术后症状未见改善1例,复查腰椎MRI,示椎间盘髓核残留,采用后路腰椎椎间融合术(PLIF)治疗,术后患者症状明显改善。其余患者未发生脊髓神经根损伤、重要血管及器官损伤、椎间隙感染等并发症。术后随访过程中,所有患者未出现复发的情况。典型病例影像学资料见图 1。
|
|
表 1 术前和术后VAS评分及ODI Table 1 VAS score and ODI of pre-operation and post-operation |
|
a,b:术前X线片示椎间隙变窄、骨赘形成c,d:术前MRI示L5/S1椎间盘突出,神经受压e,f:术中X线透视示L5/S1椎间隙置入工作通道g,h:术后MRI示椎间盘髓核被摘除、神经根未受压 a, b:Preoperative roentgenographs show narrowing of intervertebral space and osteophyte formation c, d:Preoperative MRIs show L5/S1 disc herniation and nerve compression e, f:Working channel is placed into L5/S1 intervertebral foramen, and intraoperative fluoroscopy confirms working channel place g, h:Postoperative MRIs reveal clean removal of nucleus pulposus, with no compression of L5/S1 nerve root 图 1 典型病例影像学资料 Figure 1 Radiologic data of a typical case |
ASD是指在融合术后相邻的可活动脊椎节段出现影像学退变,不一定出现临床症状,是融合手术后的一种远期并发症。随着融合手术量的增加,ASD也日益普遍,现有研究表明ASD的发生率为2.4%~50.7%[1, 12-15]。导致ASD发生的因素较多,对其发生机制尚有争议。大部分学者赞成高龄患者更易发生ASD,Sears等[12]在2011年回顾性分析了912例PLIF术后的患者临床资料,发现 > 60岁的患者发生ASD的风险为 < 45岁患者的4倍。术前邻近节段椎间盘退变对术后ASD的发生是否有影响仍然存在争议,Djurasovic等[16]进行了一项病例对照研究,采用UCLA分级系统来评价ASD组与对照组患者术前邻近节段椎间盘的退变程度,结果显示两组之间差异无统计学意义;Natarajan等[17]研究认为腰椎椎间盘退变是ASD的独立危险因素。融合节段的长度和融合术后的时间对ASD的发生也有一定的影响。Sears等[12]采用Kaplan-Meier生存分析显示,术后5、10、15年ASD发生率分别为13.6%、22.2%和27.3%,这说明随着融合术后时间的延长,ASD的发生率也逐步增高。多数学者认为多节段融合更易导致ASD的发生。Aiki等[18]回顾性分析了117例后路融合患者的随访资料,发现ASD在多节段融合中发生率为21.4%,而在单节段融合中为5.8%,两者差异有统计学意义,提示多节段融合增加ASD发生风险。此外,椎间融合方式、内固定方式、腰椎前凸角、骨盆倾斜度、小关节不对称等因素对ASD的发生也有一定的影响[15, 19-21]。
腰椎椎间盘突出症是症状性ASD的最常见形式,往往需要手术治疗。目前常用的手术方式包括PLIF、经椎板间入路经皮内窥镜下腰椎椎间盘切除术(PEID)、后路常规单纯髓核摘除术,这些手术方案可取得令人满意的临床疗效,但由于第一次全椎板切除术导致硬膜外瘢痕组织形成、硬膜与周围组织粘连,往往会影响手术操作,甚至会导致相关的并发症,如脑脊液漏,因此,其应用范围受到限制[5-7]。
Schaffer等[22]提出经皮后外侧髓核摘除术治疗椎间盘突出症,随着PETD器械的改进,其应用的范围也相应地扩大,从既往的软性椎间盘突出扩展至游离椎间盘突出、钙化椎间盘突出及腰椎椎管狭窄症等,并取得令人满意的手术效果[23-25]。虽然PETD已应用于各种类型椎间盘突出症的治疗,但对于其治疗TLIF术后相邻节段腰椎椎间盘突出的研究较少。2015年,Chen等[26]比较了PETD与常规的开放手术治疗ASD型腰椎椎间盘突出症和复发型椎间盘突出症的临床疗效,结果发现PETD可取得更好的临床疗效。本研究对28例TLIF术后相邻椎间盘突出患者采用PETD治疗,术后患者腰部及腿部疼痛症状明显缓解,末次随访患者手术优良率达89.3%(25/28)。
3.2 PETD治疗ASD型腰椎椎间盘突出症的优势PETD治疗TLIF术后ASD型腰椎椎间盘突出症具有天然的优势。首先,第一次手术会导致硬膜外瘢痕的形成,硬膜与周围组织粘连,如果第二次手术再次从后路进行操作,往往会导致相关并发症的发生,影响其临床疗效,既往相关文献报道其临床疗效优良率为70%~80%[27-28]。而PETD从后外侧经椎间孔直接将工作通道放置在硬膜的前方,可以避开初次手术形成的瘢痕组织,减少瘢痕组织对手术操作的影响,降低相关并发症的发生率,提高临床疗效。其次,常规的后路手术,包括融合及非融合手术均需要广泛剥离椎旁肌肉组织,破坏椎板及关节突,术中出血量较多,对脊柱的稳定性有一定的影响,对患者术后的恢复也有一定的影响,而PETD不需要剥离椎旁肌肉组织,可以保留正常的后路结构,对脊柱的稳定性影响较小,术中出血少,对患者术后的恢复具有积极的作用[29-30]。最后,PETD治疗TLIF术后椎间盘突出症还具有对神经脊髓干扰少,可减少术后硬膜外瘢痕形成,手术费用低等优点[31-34]。
3.3 PETD相关并发症PETD常见的并发症包括术后感觉迟钝、椎间盘髓核残留、术后复发、脑脊液漏、腹腔脏器损伤、椎间隙感染等,本研究有1例患者术后出现感觉迟钝。术后感觉迟钝由工作通道对上位神经出口根背根神经节的刺激引起,导致术后受损神经支配区域感觉障碍。虽然感觉迟钝不会危及患者的生命,但往往会对手术效果有很大的影响,值得注意。PETD治疗TLIF术后ASD型腰椎椎间盘突出症,由于内固定的影响,术中行椎间孔成形术或放置工作通道有一定的困难,术中行椎间孔成形和放置工作通道时骨锉或工作通道应尽量贴近关节面,术中应该多次透视,确定骨锉或工作通道的位置,预防对上位神经出口根的挤压和刺激,预防术后感觉迟钝的发生。本研究有1例患者第一次手术导致硬膜外瘢痕组织的增生,硬膜与瘢痕组织粘连较严重,术后分离神经需要摘除部分瘢痕组织,导致硬膜的破裂。因此术中需要小心分离神经及硬膜,不要盲目牵拉瘢痕组织,以免损伤神经及硬膜。本研究还有1例L5/S1椎间盘突出患者术后出现髓核残留,症状无法改善,主要是由于高髂嵴、横突增宽增厚、椎间孔狭窄,这种情况术中穿刺及放置工作通道比较困难,容易导致工作通道置入椎间盘内,镜下操作不能完全显露神经根的位置,易导致髓核残留。
3.4 PETD的操作要点本研究中有2例患者是L2/L3椎间盘突出,与L3/L4、L4/L5及L5/S1相比,L2/L3椎间盘突出术中操作有其独特的要点。① 穿刺点及穿刺角度:由于上腰段邻近肾脏和胸膜,L2/L3穿刺平面一般选择在椎间盘平面,穿刺点距棘突中线8~10 cm。穿刺角度尽量平一些,边穿刺边透视,触碰到上关节突骨质后再调整角度进入椎间孔。② 穿刺针所到达的位置:由于高位腰椎硬膜占椎管容积比例高,而且椎体后缘为凹陷形态,穿刺针不能进入椎管内,需要在椎间孔位置进入椎间盘。③ 工作通道的放置:工作通道可以先进入椎间盘,而后再退至椎间孔位置。放置工作通道时注意通道不能挤压腹侧的硬膜。④ 术中操作:高位腰椎椎间盘突出往往为中央型,术中需要在椎间盘内操作,以显露后纵韧带,并使之能随水流自由搏动。如果将通道后退至椎间孔位置时,小心分离可以显露硬膜走行,应用神经探棒探查硬膜前方有无上下游离的髓核。
3.5 PETD的局限性与传统开放手术相比,PETD具有创伤小、出血少、手术时间短、住院天数少、费用低、术后恢复快及并发症少等优点,但也存在一定的缺陷。
首先,对于初学者,由于存在内窥镜的视野较局限、手术入路的解剖结构与后侧入路不同及椎间孔穿刺较难等不利因素,掌握该技术需要较长的时间。其次,由于初学者对椎间孔穿刺不够熟练,往往难以做到一针到位,术中需要多次调整及反复透视,以确定穿刺针的位置,如此会增加术中的辐射量和手术时间,给医生及患者的健康带来影响。最后,由于PETD采用的是局部麻醉,疼痛敏感的患者术中往往会产生剧烈的疼痛,对于年长的患者,有可能会加重高血压、心脏病等疾病病情,严重者可能威胁到生命。
综上所述,PETD治疗TLIF术后ASD型腰椎椎间盘突出症能够取得满意的疗效,但其远期疗效还需多中心、大样本随机对照研究进一步验证。
| [1] | Xia XP, Chen HL, Cheng HB. Prevalence of adjacent segment degeneration after spine surgery:a systematic review and meta-analysis[J].Spine(Phila Pa 1976), 2013, 38(7): 597–608. DOI:10.1097/BRS.0b013e318273a2ea |
| [2] | Carragee EJ, Spinnickie AO, Alamin TF, et al. A prospective controlled study of limited versus subtotal posterior discectomy:short-term outcomes in patients with herniated lumbar intervertebral discs and large posterior anular defect[J].Spine(Phila Pa 1976), 2006, 31(6): 653–657. DOI:10.1097/01.brs.0000203714.76250.68 |
| [3] | Heifertz MD. Lumbar disc herniation:microsurgical approach[J].Neurosurgery, 2003, 53(1): 248. DOI:10.1227/01.NEU.0000072308.16102.10 |
| [4] | Lee DY, Shim CS, Ahn Y, et al. Comparison of percutaneous endoscopic lumbar discectomy and open lumbar microdiscectomy for recurrent disc herniation[J].J Korean Neurosurg Soc, 2009, 46(6): 515–521. DOI:10.3340/jkns.2009.46.6.515 |
| [5] | Cinotti G, Roysam GS, Eisenstein SM, et al. Ipsilateral recurrent lumbar disc herniation. A prospective, controlled study[J].J Bone Joint Surg Br, 1998, 80(5): 825–832. DOI:10.1302/0301-620X.80B5.8540 |
| [6] | Vishteh AG, Dickman CA. Anterior lumbar microdiscectomy and interbody fusion for the treatment of recurrent disc herniation[J].Neurosurgery, 2001, 48(2): 334–337. |
| [7] | Cinotti G, Gumina S, Giannicola G, et al. Contralateral recurrent lumbar disc herniation. Results of discectomy compared with those in primary herniation[J].Spine (Phila Pa 1976), 1999, 24(8): 800–806. DOI:10.1097/00007632-199904150-00012 |
| [8] | Ozgen S, Naderi S, Ozek MM, et al. Findings and outcome of revision lumbar disc surgery[J].Spinal Disord, 1999, 12(4): 287–292. |
| [9] | Huskisson EC. Measurement of pain[J].Lancet, 1974, 2(7889): 1127–1131. |
| [10] | Fairbank JC, Couper J, Davies JB, et al. The Oswestry low back pain disability questionnaire[J].Physiotherapy, 1980, 66(8): 271–273. |
| [11] | MacNab I. Negative disc exploration. An analysis of the causes of nerve-root involvement in sixty-eight patients[J].J Bone Joint Surg Am, 1971, 53(5): 891–903. DOI:10.2106/00004623-197153050-00004 |
| [12] | Sears WR, Sergides IG, Kazemi N, et al. Incidence and prevalence of surgery at segments adjacent to a previous posterior lumbar arthrodesis[J].Spine J, 2011, 11(1): 11–20. DOI:10.1016/j.spinee.2010.09.026 |
| [13] | Maruenda JI, Barrios C, Garibo F, et al. Adjacent segment degeneration and revision surgery after circumferential lumbar fusion:outcomes throughout 15 years of follow-up[J].Eur Spine J, 2016, 25(5): 1550–1557. DOI:10.1007/s00586-016-4469-5 |
| [14] | Nakashima H, Kawakami N, Tsuji T, et al. Adjacent segment disease after posterior lumbar interbody fusion:based on cases with a minimum of 10 years of follow-up[J].Spine(Phila Pa 1976), 2015, 40(14): E831–841. DOI:10.1097/BRS.0000000000000917 |
| [15] | Masevnin S, Ptashnikov D, Michaylov D, et al. Risk factors for adjacent segment disease development after lumbar fusion[J].Asian Spine J, 2015, 9(2): 239–244. DOI:10.4184/asj.2015.9.2.239 |
| [16] | Djurasovic MO, Carreon LY, Glassman SD, et al. Sagittal alignment as a risk factor for adjacent level degeneration:a case-control study[J].Orthopedics, 2008, 31(6): 546. |
| [17] | Natarajan RN, Andersson GB. Lumbar disc degeneration is an equally important risk factor as lumbar fusion for causing adjacent segment disc disease[J].J Orthop Res, 2017, 35(1): 123–130. DOI:10.1002/jor.v35.1 |
| [18] | A iki H, Ohwada O, Kobayashi H, et al. Adjacent segment stenosis after lumbar fusion requiring second operation[J].J Orthop Sci, 2005, 10(5): 490–495. DOI:10.1007/s00776-005-0919-3 |
| [19] | Ghasemi AA. Adjacent segment degeneration after posterior lumbar fusion:An analysis of possible risk factors[J].Clin Neurol Neurosurg, 2016, 143: 15–18. DOI:10.1016/j.clineuro.2016.02.004 |
| [20] | Yee TJ, Terman SW, La Marca F, et al. Comparison of adjacent segment disease after minimally invasive or open transforaminal lumbar interbody fusion[J].J Clin Neurosci, 2014, 21(10): 1796–1801. DOI:10.1016/j.jocn.2014.03.010 |
| [21] | Kim JY, Ryu DS, Paik HK, et al. Paraspinal muscle, facet joint, and disc problems:risk factors for adjacent segment degeneration after lumbar fusion[J].Spine J, 2016, 16(7): 867–875. DOI:10.1016/j.spinee.2016.03.010 |
| [22] | Schaffer JL, Kambin P. Percutaneous posterolateral lumbar discectomy and decompression with a 6.9-millimeter cannula. Analysis of operative failures and complications[J].J Bone Joint Surg Am, 1991, 73(6): 822–831. DOI:10.2106/00004623-199173060-00005 |
| [23] | Ahn Y, Oh HK, Kim H, et al. Percutaneous endoscopic lumbar foraminotomy:an advanced surgical technique and clinical outcomes[J].Neurosurgery, 2014, 75(2): 124–133. DOI:10.1227/NEU.0000000000000361 |
| [24] | Choi G, Lee SH, Lokhande P, et al. Percutaneous endoscopic approach for highly migrated intracanal disc herniations by foraminoplastic technique using rigid working channel endoscope[J].Spine(Phila Pa 1976), 2008, 33(15): E508–515. DOI:10.1097/BRS.0b013e31817bfa1a |
| [25] | Hoogland T, van den Brekel-Dijkstra K, Schubert M, et al. Endoscopic transforaminal discectomy for recurrent lumbar disc herniation:a prospective, cohort evaluation of 262 consecutive cases[J].Spine(Phila Pa 1976), 2008, 33(9): 973–978. DOI:10.1097/BRS.0b013e31816c8ade |
| [26] | Chen HC, Lee CH, Wei L, et al. Comparison of percutaneous endoscopic lumbar discectomy and open lumbar surgery for adjacent segment degeneration and recurrent disc herniation[J].Neurol Res Int, 2015, 2015: 791943. |
| [27] | Smith JS, Ogden AT, Shafizadeh S, et al. Clinical outcomes after microendoscopic discectomy for recurrent lumbar disc herniation[J].Spinal Disord Tech, 2010, 23(1): 30–34. DOI:10.1097/BSD.0b013e318193c16c |
| [28] | Dai LY, Zhou Q, Yao WF, et al. Recurrent lumbar disc herniation after discectomy:outcome of repeat discectomy[J].Surg Neurol, 2005, 64(3): 226–231. DOI:10.1016/j.surneu.2004.11.003 |
| [29] | Osman SG, Nibu K, Panjabi MM, et al. Transforaminal and posterior decompressions of the lumbar spine. A comparative study of stability and intervertebral foramen area[J].Spine(Phila Pa 1976), 1997, 22(15): 1690–1695. DOI:10.1097/00007632-199708010-00002 |
| [30] | Pan L, Zhang P, Yin Q. Comparison of tissue damages caused by endoscopic lumbar discectomy and traditional lumbar discectomy:a randomised controlled trial[J].Int J Surg, 2014, 12(5): 534–537. DOI:10.1016/j.ijsu.2014.02.015 |
| [31] | Kim JS, Lee SH, Moon KH, et al. Surgical results of the oblique paraspinal approach in upper lumbar disc herniation and thoracolumbar junction[J].Neurosurgery, 2009, 65(1): 95–99. DOI:10.1227/01.NEU.0000348299.89232.C2 |
| [32] | 魏振, 夏青, 江海良, 等. 改良经椎间孔椎体间融合术治疗高位腰椎间盘突出症[J].中国骨伤, 2010, 23(4): 308–310. |
| [33] | Hioki A, Miyamoto K, Hosoe H, et al. Cantilever transforaminal lumbar interbody fusion for upper lumbar degenerative diseases(minimum 2 years follow up)[J].Yonsei Med J, 2011, 52(2): 314–321. DOI:10.3349/ymj.2011.52.2.314 |
| [34] | 庄青山, 徐兆万, 隋国侠, 等. Quadrant通道下"L"型截骨刀经椎间孔截骨椎间融合内固定术治疗高位腰椎间盘突出症[J].中华医学杂志, 2014, 94(37): 2929–2933. |
 2017, Vol.15
2017, Vol.15  Issue(3): 161-166
Issue(3): 161-166


