2. 江西省上饶平安医院脊柱外科, 江西 334000
2. Department of Spinal Surgery, Shangrao Ping'an Hospital, Shangrao 334000, Jiangxi, China
椎间盘是人体最大的无血管组织,仅有少量的血管分布[1]。因此,低氧环境是椎间盘内髓核组织重要的生理环境[2-3]。低氧能够诱导髓核细胞中低氧诱导因子1α(HIF-1α)的表达,后者对髓核细胞的存活及其细胞外基质的代谢具有重要作用,进而参与椎间盘退变的病理生理进程[4-7]。研究表明,解聚蛋白样金属蛋白酶(ADAMTS)家族在椎间盘退行性变的过程中发挥重要作用,其中ADAMTS-4和ADAMTS-5是目前公认的最为重要的聚蛋白聚糖降解酶,二者能够直接作用于髓核细胞外基质聚蛋白聚糖并将其彻底水解,从而破坏细胞外基质,在椎间盘退变过程中发挥核心作用[8]。研究表明,低氧环境及ADAMTS-4、ADAMTS-5对椎间盘细胞外基质代谢均具有重要作用[9-10]。本研究拟观察低氧及HIF-1α对髓核细胞中ADAMTS-4和ADAMTS-5表达的调控作用,探讨影响椎间盘退行性变的分子机制,以期为椎间盘退行性变的生物治疗提供新的靶点和思路。
1 材料和方法 1.1 材料人Pβ-gal基载体ADAMTS-4和ADAMTS-5启动子由礼来研究实验室Thirunavukkarasu博士馈赠,HIF-1α过表达质粒、显性负突变HIF-1α(DN-HIF-1α)质粒由斯克里普斯研究所Jiahui Han博士馈赠,pRL-TK海肾荧光素酶质粒、双荧光素酶报告基因检测系统(Dual LuciferaseTM Reporter Assay System)、质粒提纯试剂盒购自Promega公司,Anti-ADAMTS-4和Anti-ADAMTS-5抗体购自Abcam公司,lipofectamine2000转染试剂购自Invitrogen公司,胰酶-EDTA、DMEM培养基、胎牛血清购自Gibco公司,DNA提取试剂盒、DNA纯化试剂盒购自Qiagen公司,SDS-PAGE凝胶配制试剂盒购自碧云天生物技术有限公司。
1.2 PGL3-ADAMTS-4和PGL3-ADAMTS-5基因质粒构建方法用内切酶将ADAMTS-4和ADAMTS-5启动子片段分别自Pβ-gal基载体中切出,同时将PGL3空载体的上游和下游分别切开。琼脂糖凝胶电泳后,将所得DNA片段进行提取、纯化。对获取的ADAMTS-4和ADAMTS-5启动子片段测序,并使用JASPAR数据库[11]来研究其中是否存在HIF-1α的结合位点。16℃下将ADAMTS-4和ADAMTS-5片段分别与PGL3连接,转入大肠杆菌,涂至含氨苄青霉素的琼脂糖培养板,37℃孵箱过夜。挑取有效存活细菌,纯化后进行DNA琼脂糖凝胶电泳确认质粒构建正确。
1.3 髓核细胞的分离和培养用Risbud等[12]的方法分离获取大鼠原代髓核细胞,37℃、5%CO2孵箱孵育48 h后换培养液,之后每2 d换一次培养液,按时观察细胞形态。当细胞长满约80%培养皿时按1:3进行传代。向待传代细胞培养瓶中加适量0.25%胰酶-EDTA,置入37℃孵箱30 s,确认细胞浮起后加入培养液中和胰酶,离心5 min后(1 000 r/min,离心半径为10 cm)弃上清液,加入新鲜培养液后将细胞分置新培养瓶。
1.4 低氧对细胞中ADAMTS-4和ADAMTS-5蛋白表达的影响将体外培养的大鼠髓核细胞分别置于常氧和低氧(1% O2)培养箱培养,以常氧培养髓核细胞为对照组,以低氧培养4、8和24 h的髓核细胞为实验组,使用蛋白质印迹法检测髓核细胞中ADAMTS-4和ADAMTS-5蛋白表达。ADAMTS-4相对分子质量约为90 000,ADAMTS-5相对分子质量约为73 000。提取髓核细胞蛋白,测定蛋白含量,以8%分离胶进行SDS-PAGE,恒电压80 V,恒电流220 mA,90 min后转至硝酸纤维素膜。将膜移至含有封闭液的平皿中,室温下于脱色摇床上摇动封闭1 h。加入Anti-ADAMTS-4(工作浓度1:1 500)和Anti-ADAMTS-5抗体(工作浓度1:250),4℃孵育过夜,回收一抗清洗后加入二抗孵育1 h,清洗后显影。
1.5 低氧对细胞中ADAMTS-4和ADAMTS-5 mRNA表达的影响以常氧培养髓核细胞为对照组,以低氧培养1、4和8 h的髓核细胞为实验组,使用PCR方法检测髓核细胞中ADAMTS-4和ADAMTS-5 mRNA表达。依照TRIzol Reagent说明提取细胞RNA,使用超微量分光光度计检测RNA浓度及纯度,将浓度过高的RNA进行适当比例的稀释,使其终浓度为200 ng/μL,按RevertAid First Strand cDNA Synthesis Kit反转录试剂盒说明合成cDNA。引物由武汉擎科创新生物科技有限公司合成,序列如下:R-ADAMTS-4-S为5'-TACAACCACCGAACCGACCT-3',R-ADAMTS-4-A为5'-AAGAGTCTGGGGAACAGGGAG-3',片段长度为178 bp;R-ADAMTS-5-S为5'-CCGACAAGAGTCTGGAGGTGA-3'G,R-ADAMTS-5-A为5'-CTGCATCGTAGTGCTCCTCATG-3',片段长度为114 bp。应用PCR方法,按照Fast Start Universal SYBR Green Master(Rox)试剂说明,以GAPDH为内参,检测样本中ADAMTS-4、ADAMTS-5 mRNA的表达。
1.6 低氧对细胞中ADAMTS-4和ADAMTS-5启动子转录活性的影响将PGL3-ADAMTS-4和PGL3-ADAMTS-5报告基因分别转染髓核细胞,以常氧培养的转染细胞为对照组,以低氧培养2、8 h的转染细胞为实验组,使用双荧光素酶报告基因检测系统检测ADAMTS-4和ADAMTS-5启动子转录活性。细胞培养于24孔板,每孔细胞中加入裂解液100 μL,置于室温摇床裂解15 min,取15 μL细胞裂解悬液,加入荧光素酶测试试剂Ⅱ(LARⅡ)50 μL,读取荧光值,再加入Stop & GloTM 50 μL,读取荧光值,以后者为校正内参,二者比值即为获得校正后读数。
1.7 HIF-1α过表达对细胞中ADAMTS-4和ADAMTS-5启动子转录活性的影响将100、200、300 ng HIF-1α过表达质粒分别与PGL3-ADAMTS-4报告基因共转染髓核细胞。以转染PGL3-ADAMTS-4报告基因为对照组,以共转染HIF-1α过表达质粒和PGL3-ADAMTS-4为实验组,使用双荧光素酶报告基因检测系统检测HIF-1α过表达质粒对ADAMTS-4启动子活性影响。同法检测HIF-1α过表达质粒对ADAMTS-5启动子活性的影响。
1.8 HIF-1α低表达对低氧环境下细胞中ADAMTS-4和ADAMTS-5启动子转录活性的影响将DN-HIF-1α与PGL3-ADAMTS-4共转染髓核细胞。以转染PGL3-ADAMTS-4报告基因、常氧培养的髓核细胞为对照组,以共转染0、100、200、300 ng DN-HIF-1α质粒和PGL3-ADAMTS-4、低氧干预8 h的髓核细胞为实验组,使用双荧光素酶报告基因检测系统检测DN-HIF-1α对ADAMTS-4启动子活性的影响。同法检测DN-HIF-1α对ADAMTS-5启动子活性的影响。
1.9 统计学处理采用SPSS 17.0软件对数据进行统计学分析。所有实验独立重复3次,数据以x±s表示,采用方差分析(ANOVA)进行组间比较,以P<0.05为差异有统计学意义。
2 结果 2.1 低氧对髓核细胞中ADAMTS-4和ADAMTS-5表达的调控作用蛋白质印迹分析结果显示低氧显著抑制髓核细胞中ADAMTS-4、ADAMTS-5的表达,并且该抑制作用具有时间依赖性(P<0.05,图 1)。为了进一步验证以上结果,使用PCR在mRNA水平对ADAMTS-4和ADAMTS-5的表达进行检测,结果显示,低氧能够在mRNA水平显著抑制ADAMTS-4和ADAMTS-5的表达(P<0.05,图 2)。
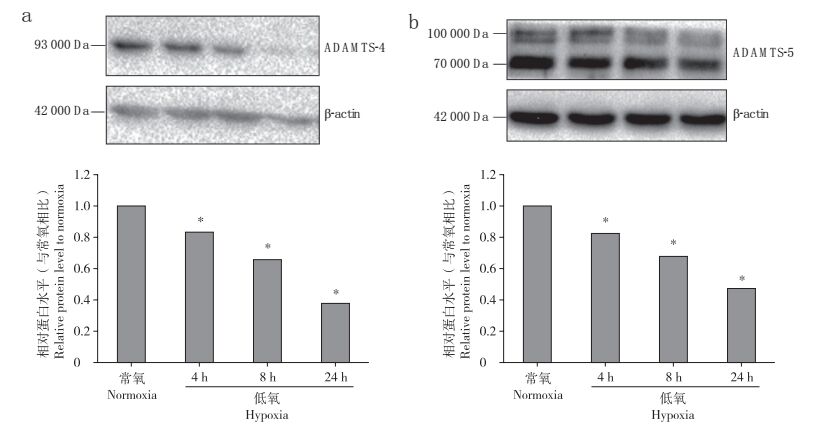
|
a:ADAMTS-4 b:ADAMTS-5 *与常氧对照组比较,P<0.05 a: ADAMTS-4 b: ADAMTS-5 * P < 0.05, compared with normoxia 图 1 蛋白质印迹法检测低氧对髓核细胞中ADAMTS-4、ADAMTS-5蛋白表达的影响 Figure 1 Effect of hypoxia on ADAMTS-4 and ADAMTS-5 protein expression in nucleus pulposus cells by Western blotting |
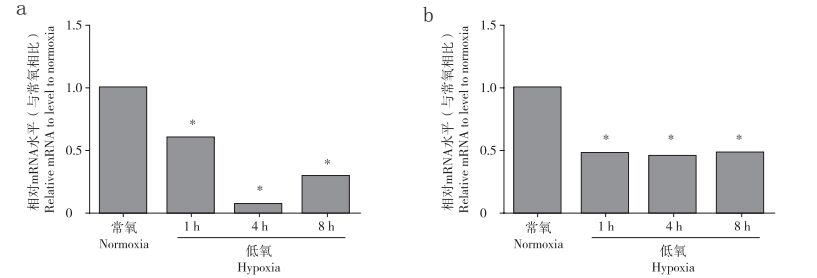
|
a:ADAMTS-4 b:ADAMTS-5 *与常氧对照组比较,P<0.05 a: ADAMTS-4 b: ADAMTS-5 * P < 0.05, compared with normoxia 图 2 PCR检测低氧对髓核细胞中ADAMTS-4、ADAMTS-5 mRNA表达的影响 Figure 2 Effect of hypoxia on ADAMTS-4 and ADAMTS-5 mRNA expression in nucleus pulposus cells by PCR |
对获取的ADAMTS-4和ADAMTS-5启动子片段测序,并使用JASPAR数据库来研究其中是否存在HIF-1α的结合位点。结果显示在ADAMTS-4启动子转录起始点上游-3 082~-3 075碱基处有1个HIF-1α的结合位点,为“CTGCGTGG”序列。ADAMTS-5启动子转录起始点上游-4 020~-4 013碱基处有1个HIF-1α的结合位点,为“GTACGTGT”序列;-802~-795碱基处有1个HIF-1α的结合位点,为“AGGCGTGC”序列。
2.3 低氧及HIF-1α对ADAMTS-4和ADAMTS-5启动子的调控作用构建PGL3-ADAMTS-4和PGL3-ADAMTS-5报告基因并将其转染髓核细胞,采用双荧光素酶报告基因检测系统进行检测,结果显示低氧能够抑制ADAMTS-4和ADAMTS-5启动子启动转录(P<0.05,图 3)。随后,将HIF-1α过表达质粒分别与PGL3-ADAMTS-4或PGL3-ADAMTS-5报告基因共转染髓核细胞,双荧光素酶报告基因检测系统结果显示HIF-1α能够抑制ADAMTS-4和ADAMTS-5启动子活性,且该抑制作用与HIF-1α过表达质粒的剂量呈正相关性(P<0.05,图 4)。为了进一步明确HIF-1α的作用,将DN-HIF-1α与PGL3-ADAMTS-4或PGL3-ADAMTS-5分别共转染髓核细胞,结果显示DN-HIF-1α能够拮抗低氧对ADAMTS-4和ADAMTS-5启动子活性的抑制作用(图 5)。
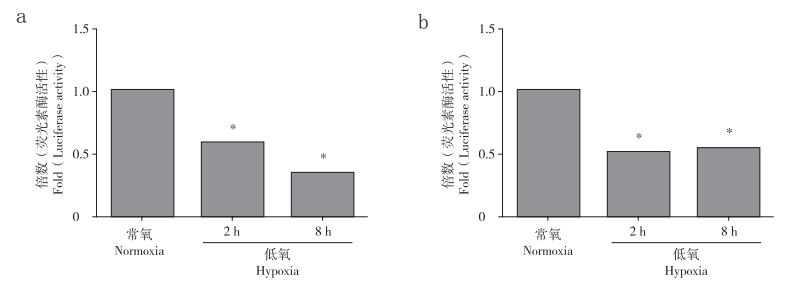
|
a:ADAMTS-4 b:ADAMTS-5 *与常氧对照组比较,P<0.05 a: ADAMTS-4 b: ADAMTS-5 * P < 0.05, compared with normoxia 图 3 双荧光素酶报告基因检测系统检测低氧对髓核细胞中ADAMTS-4、ADAMTS-5启动子活性的影响 Figure 3 Effect of hypoxia on promoter activity of ADAMTS-4 and ADAMTS-5 in nucleus pulposus cells by dual luciferase reporter assay system |
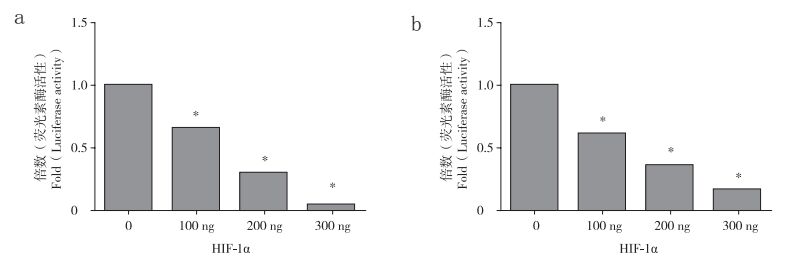
|
a:ADAMTS-4 b:ADAMTS-5 *与常氧对照组比较,P<0.05 a: ADAMTS-4 b: ADAMTS-5 * P < 0.05, compared with normoxia 图 4 双荧光素酶报告基因检测系统检测HIF-1α对髓核细胞中ADAMTS-4、ADAMTS-5启动子活性的影响 Figure 4 Effect of HIF-1α on promoter activity of ADAMTS-4 and ADAMTS-5 in nucleus pulposus cells by dual luciferase reporter assay system |

|
a:ADAMTS-4 b:ADAMTS-5 *与常氧对照组比较,P<0.05 a: ADAMTS-4 b: ADAMTS-5 * P < 0.05, compared with normoxia 图 5 双荧光素酶报告基因检测系统检测DN-HIF-1α对低氧8 h环境下髓核细胞中ADAMTS-4、ADAMTS-5启动子活性的影响 Figure 5 Effect of DN-HIF-1α on promoter activity of ADAMTS-4 and ADAMTS-5 in nucleus pulposus cells under hypoxia 8 h environment by dual luciferase reporter assay system |
ADAMTS为新发现的一类Zn2+依赖的分泌型金属蛋白酶,正常髓核细胞分泌的ADAMTS-4和ADAMTS-5参与调节保持椎间盘内环境的平衡。同基质金属蛋白酶(MMP)通过诱导巨噬细胞浸润间接水解蛋白聚糖[13]不同,ADAMTS-4和ADAMTS-5可以直接水解蛋白聚糖[14]。相比于正常髓核细胞,退变髓核细胞中ADAMTS-4和ADAMTS-5水平的上调可引发椎间盘内环境稳态失衡而促进椎间盘退变[15]。
HIF-1普遍存在于人和哺乳动物细胞内,是在基因转录水平调节细胞低氧反应的重要调节因子。HIF-1由α亚基和β亚基组成,其中β亚基持续性表达,为芳香烃受体转运子;α亚基包括1个氧依赖降解结构域(正常氧分压下HIF-1降解所必需的结构)和2个反式激活结构域(主要参与转录激活作用)。椎间盘氧分压从外层纤维环到中间髓核呈锐减趋势,正常椎间盘外层纤维环的氧分压约为7.5 kPa,髓核中心的氧分压仅为0.5 kPa;而在退变椎间盘组织中,髓核中心的氧分压为1.04 ~ 12.67 kPa[16-17]。相比于正常髓核细胞,退变髓核细胞中HIF-1α表达明显降低[18]。
本实验证实在低氧状态下,ADAMTS-4和ADAMTS-5表达显著降低,并且该调控过程处于启动子转录水平。为探明HIF-1α在其中的作用,本实验利用克隆的ADAMTS-4和ADAMTS-5片段构建了ADAMTS-4和ADAMTS-5双荧光素酶报告基因质粒,对获取的ADAMTS-4和ADAMTS-5启动子片段测序分析,结果示ADAMTS-4与ADAMTS-5启动子上游均存在高度可能性的HIF-1α结合位点。将HIF-1α分别与ADAMTS-4和ADAMTS-5报告基因共转染至髓核细胞后,HIF-1α能够显著抑制ADAMTS-4和ADAMTS-5启动子活性,此外DN-HIF-1α却能够拮抗低氧对ADAMTS-4和ADAMTS-5启动子活性的抑制作用。既往的研究结果显示,低氧状态能够诱导髓核细胞发生细胞自噬,并且促进热休克蛋白的表达,从而确保缺乏营养物质的髓核细胞存活。并且,低氧通过HIF-1α诱导细胞外基质合成的关键酶——葡萄糖醛酸基转移酶的表达,从而使椎间盘细胞外基质合成[19]。而本研究结果从另一个方面显示了低氧对椎间盘的保护作用:低氧可能通过抑制椎间盘中某些重要的降解代谢因素,从而保护椎间盘细胞外基质的丢失。由此推测,在正常髓核中低氧通过调节HIF-1α的产生抑制ADAMTS-4和ADAMTS-5启动子活性从而降低其表达,使生理状态下细胞外基质不被破坏,保持椎间盘内环境的稳态,延缓椎间盘退变的发生。
| [1] | Semenza GL. Hypoxia-inducible factor 1:oxygen homeostasis and disease pathophysiology[J]. Trends Mol Med, 2001, 7(8): 345–350. DOI:10.1016/S1471-4914(01)02090-1 |
| [2] | Bekeredjian R, Walton CB, MacCannell KA, et al. Conditional HIF-1alpha expression produces a reversible cardiomyopathy[J]. PLoS One, 2010, 5(7): e11693. DOI:10.1371/journal.pone.0011693 |
| [3] | Li H, Liang CZ, Chen QX. Regulatory role of hypoxia inducible factor in the biological behavior of nucleus pulposus cells[J]. Yonsei Med J, 2013, 54(4): 807–812. DOI:10.3349/ymj.2013.54.4.807 |
| [4] | Merceron C, Mangiavini L, Robling A, et al. Loss of HIF-1α in the notochord results in cell death and complete disappearance of the nucleus pulposus[J]. PLoS One, 2014, 9(10): e110768. DOI:10.1371/journal.pone.0110768 |
| [5] | Bibby SR, Urban JP. Effect of nutrient deprivation on the viability of intervertebral disc cells[J]. Eur Spine J, 2004, 13(8): 695–701. DOI:10.1007/s00586-003-0616-x |
| [6] | Horner HA, Urban JP. 2001 Volvo Award Winner in Basic Science Studies:Effect of nutrient supply on the viability of cells from the nucleus pulposus of the intervertebral disc[J]. Spine(Phila Pa 1976), 2001, 26(23): 2543–2549. DOI:10.1097/00007632-200112010-00006 |
| [7] | Zeng Y, Danielson KG, Albert TJ, et al. HIF-1 alpha is a regulator of galectin-3 expression in the intervertebral disc[J]. J Bone Miner Res, 2007, 22(12): 1851–1861. DOI:10.1359/jbmr.070620 |
| [8] | Abbaszade I, Liu RQ, Yang F, et al. Cloning and characterization of ADAMTS11, an aggrecanase from the ADAMTS family[J]. J Biol Chem, 1999, 274(33): 23443–23450. DOI:10.1074/jbc.274.33.23443 |
| [9] | Arai M, Anderson D, Kurdi Y, et al. Effect of adenovirus-mediated overexpression of bovine ADAMTS-4 and human ADAMTS-5 in primary bovine articular chondrocyte pellet culture system[J]. Osteoarthritis Cartilage, 2004, 12(8): 599–613. DOI:10.1016/j.joca.2004.05.001 |
| [10] | Hui W, Barksby HE, Young DA, et al. Oncostatin M in combination with tumour necrosis factor {alpha} induces a chondrocyte membrane associated aggrecanase that is distinct from ADAMTS aggrecanase-1 or -2[J]. Ann Rheum Dis, 2005, 64(11): 1624–1632. DOI:10.1136/ard.2004.028191 |
| [11] | Wasserman WW, Sandelin A. Applied bioinformatics for the identification of regulatory elements[J]. Nat Rev Genet, 2004, 5(4): 276–287. DOI:10.1038/nrg1315 |
| [12] | Risbud MV, Guttapalli A, Stokes DG, et al. Nucleus pulposus cells express HIF-1 alpha under normoxic culture conditions:a metabolic adaptation to the intervertebral disc microenvironment[J]. J Cell Biochem, 2006, 98(1): 152–159. DOI:10.1002/(ISSN)1097-4644 |
| [13] | Haro H, Shinomiya K, Murakami S, et al. Up-regulated expression of matrilysin and neutrophil collagenase in human herniated discs[J]. J Spinal Disord, 1999, 12(3): 245–249. |
| [14] | Tortorella MD, Burn TC, Pratta MA, et al. Purification and cloning of aggrecanase-1:a member of the ADAMTS family of proteins[J]. Science, 1999, 284(5420): 1664–1666. DOI:10.1126/science.284.5420.1664 |
| [15] | Patel KP, Sandy JD, Akeda K, et al. Aggrecanases and aggrecanase-generated fragments in the human intervertebral disc at early and advanced stages of disc degeneration[J]. Spine(Phila Pa 1976), 2007, 32(23): 2596–2603. DOI:10.1097/BRS.0b013e318158cb85 |
| [16] | Urban JP. The role of the physicochemical environment in determining disc cell behaviour[J]. Biochem Soc Trans, 2002, 30(Pt 6): 858–864. |
| [17] | Bartels EM, Fairbank JC, Winlove CP, et al. Oxygen and lactate concentrations measured in vivo in the intervertebral discs of patients with scoliosis and back pain[J]. Spine(Phila Pa 1976), 1998, 23(1): 1–8. DOI:10.1097/00007632-199801010-00001 |
| [18] | Chen S, Fang XQ, Wang Q, et al. PHD/HIF-1 upregulates CA12 to protect against degenerative disc disease:a human sample, in vitro and ex vivo study[J]. Lab Invest, 2016, 96(5): 561–569. DOI:10.1038/labinvest.2016.32 |
| [19] | Rouschop KM, van den Beucken T, Dubois L, et al. The unfolded protein response protects human tumor cells during hypoxia through regulation of the autophagy genes MAP1LC3B and ATG5[J]. J Clin Invest, 2010, 120(1): 127–141. DOI:10.1172/JCI40027 |
 2017, Vol.15
2017, Vol.15  Issue(4): 233-238
Issue(4): 233-238


