2. 第二军医大学附属长征医院神经内科, 上海 200003;
3. 第二军医大学附属长征医院闸北分院骨科, 上海 200070
2. Department of Neurology, Changzheng Hospital, Secondary Military Medical University, Shanghai 200003, China;
3. Department of Orthopaedics, Zhabei Branch of Changzheng Hospital, Second Military Medical University, Shanghai 200070, China
肌萎缩型颈椎病(CSA)又称为“Keegan型颈椎病”,主要表现为单/双侧上肢肌肉萎缩(单侧为主),通常伴/不伴轻度的感觉异常及脊髓病变,是颈椎病的一种特殊类型,发生率较低[1],容易与运动神经元病、平山病、脊肌萎缩症等疾病混淆,造成漏诊、误诊。本院2015年8月收治1例远端型CSA患者,现将诊疗过程报告如下。
1 病例资料患者男,60岁,因“双上肢疼痛、麻木伴右手肌肉萎缩10余年”收住本院。患者于10余年前无明显诱因出现双上肢疼痛、麻木,右侧重,伴右手肌肉萎缩(以大鱼际肌和小鱼际肌为主),多次于当地医院就诊,并接受非手术治疗;7年前在当地医院行“右侧尺神经减压松解修复术”,术后肌肉萎缩无缓解。本次入院前10 d患者双上肢疼痛、麻木进一步加重,经非手术治疗无效来本院就诊。查体:步入病房,步态稳;颈椎活动轻度受限,无压痛;双上肢肌力(MMT分级[2])4级,双下肢肌力5级,右手大小鱼际肌萎缩,伴右手静止性震颤,双侧肱二头肌、肱三头肌腱反射正常;双侧Hoffman征阴性,双下肢感觉运动无异常。疼痛视觉模拟量表(VAS)评分[3] 7分。
血常规、血生化检查正常。颈椎MRI示颈椎退变,生理曲度变直,局部反弓(图 1a),C4/C5/C6/C7椎间盘突出,偏右侧型;颈髓内多节段不规则线性高信号改变(矢状位,图 1a),伴多节段脊髓前角(AH)内欠对称性小区域的高信号(横断面,图 1b~e)改变,即“蛇眼征”,以C3 ~ 6节段为主;颈椎X线片示颈椎退变,生理曲度变直,局部反弓(图 1f)。颈椎CT未见后纵韧带骨化及黄韧带骨化。肌电图(EMG)显示右上肢神经源性损伤电生理改变,以C8、T1节段支配肌肉累及为主,考虑颈神经根、AH受损可能。
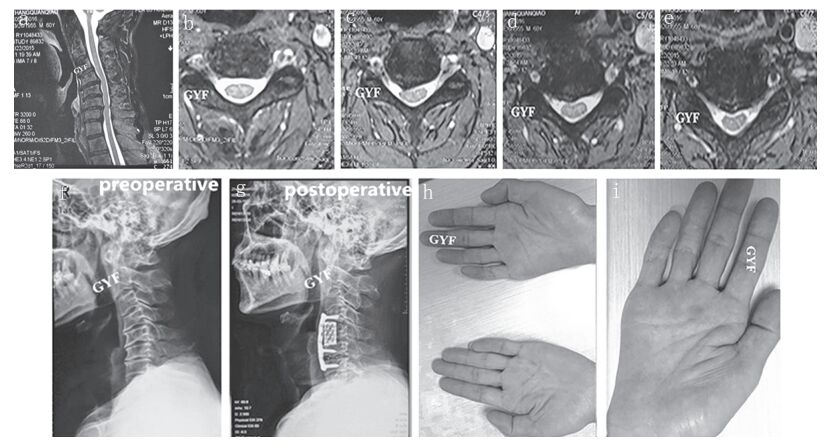
|
a:颈椎矢状位MRI示颈椎退变,局部反弓,C4/C5/C6/C7椎间盘突出b ~e:颈椎横断面位MRI示C4/C5/C6/C7椎间盘突出,偏右侧型,C3~6节段脊髓内欠对称性高信号改变f:术前颈椎X线片示颈椎退变,局部反弓g:术后颈椎X线片示内固定位置良好h,i:术后10个月随访,右手大小鱼际肌萎缩无明显改善 图 1 病例影像学资料 |
根据临床表现及辅助检查,入院诊断为远端型CSA,排除手术禁忌证,并于术前进一步完善相关检查,全麻下行颈前路C6/C7椎间盘切除并C5椎体次全切除减压内固定融合术(图 1g):患者仰卧位,颈部后伸,插管全麻,颈前横形切口。依次切开皮肤、皮下组织及颈阔肌,暴露至椎前,透视定位后切除C6/C7椎间盘及上下终板软骨,逐渐切除椎间隙后部突出的椎间盘,用薄神经剥离子贴骨面探查推移后贴着骨面去除增生的钩椎关节骨赘,彻底切除椎体后上、后下缘骨赘,椎盘组织及后纵韧带,试模后于C6/C7置入1枚合适大小的cage(碳纤维);切除C4/C5/C6椎间盘及上下终板软骨,咬除C5椎体,彻底切除椎体后壁及后缘增生缘骨赘、椎盘组织及后纵韧带,置入1枚合适长度的钛网,颈椎前路钛板螺钉固定,彻底止血后逐层缝合切口。
术后早期给予营养神经、抗炎对症支持治疗,颈托制动3个月。随访10个月,双上肢肌肉疼痛、麻木完全缓解,右手静止性震颤无明显缓解,右手大小鱼际肌萎缩无明显改善(图 1h,i);VAS评分1分。
3 讨论CSA是颈椎病的一种特殊类型,以节段性、非对称性、稳定性上肢肌肉萎缩为特征,发生机制尚不完全清楚,目前认为与颈椎退变导致的AH细胞缺血性损伤及脊髓前根(腹侧根)选择性损伤有关[1]。
Keegan[4]通过尸检证实腹侧神经根选择性损伤是CSA的发生原因之一,另外Luschka关节被证实在腹侧神经根选择性损伤中发挥重要作用[1, 5]。Kameyamak等[6]认为脊髓前动脉供血不足导致节段性AH细胞损伤是CSA的另一发生机制。AH主要接受脊髓前动脉的终末支沟动脉的供血,容易发生缺血性损伤。在颈椎退变椎管狭窄的基础上,颈椎屈伸活动(如反复或持续的屈曲姿势)引发脊髓移动[6],导致脊髓内外血管发生压迫或牵拉从而影响脊髓内供血[1, 6]。此外,部分CSA患者MRI T2加权像可以观察到AH内对称性高信号改变,即“蛇眼征”,为AH细胞缺血性损伤提供了影像学支持证据[1]。另外,有学者认为中央型致压物导致的AH及腹侧神经根选择性损伤共同参与CSA的发生[1, 5, 7]。CSA以退变为基础,但有学者认为CSA同颈椎退变程度无明显关系,属于亚临床型颈椎病[8]。在本病例中,MRI显示颈椎椎间盘突出较轻,脊髓信号改变明显,呈典型的“蛇眼征”;且C3,4节段脊髓无压迫,但脊髓信号改变明显。本研究组认为颈椎退变介导的脊髓内外血管压迫或牵拉所致的AH缺血性损伤是该患者肌肉萎缩的主要机制。此外,陈世铮等[9]研究显示,脊髓损伤后会以损伤节段为中心波及周围多个节段(通常为1 ~ 2个节段),形成锥形或梭形坏死及囊性变,尤其是脊髓丘脑束的白质前连合区域,可能进一步造成脊髓损伤范围增加。C3,4节段脊髓信号改变可能与该机制有关。
CSA主要表现为上肢肌肉萎缩,30 ~ 60岁男性多见(尤其> 50岁男性)[1, 10],单侧为主,肌肉萎缩的分布与分型密切相关,呈不对称性、节段性,而且具有局限性、稳定性、自限性等特点[1, 7]。早期报道显示CSA多无感觉异常[1],有学者提出CSA偶尔可伴有感觉异常,如上肢短暂性或一过性根性症状[11-12]、下肢麻木、腱反射亢进等[11]。本病例中,肌肉萎缩伴有双上肢疼痛、麻木,研究组认为与脊髓神经根及脊髓受压的解剖部位有关,且无感觉异常不能作为诊断CSA的必要条件。此外,远端型CSA(C7、C8、T1肌节)的发生率明显低于近端型(C5、C6肌节),可能与C5节段的脊髓和神经根的解剖特点及颈椎的生物力学特点有关[13]。
CSA的诊断主要依靠上肢肌肉萎缩、影像学资料及EMG检查综合诊断,同时需要同运动神经元性疾病、平山病、脊肌萎缩症等疾病相鉴别[1],尤其是肌萎缩性脊髓侧索硬化症(ALS),二者主要见于中老年男性。据统计,约40%的ALS早期表现为上肢或下肢不对称性的肌肉萎缩,与CSA的鉴别存在一定的困难[11],而且CSA合并ALS的相关报道并不少见[14],因此是首要鉴别的疾病之一。肌萎缩的特点(节段性或广泛弥漫分布、稳定性或进展性),眼球肌、胸锁乳突肌和舌肌受累情况(EMG)及MRI表现(脊髓压迫征象)是二者的主要鉴别点[1]。此外,平山病与远端型CSA均表现为上肢远端肌肉萎缩,且发生机制与影像学表现有一定的重叠性。发病年龄及萎缩肌群的分布是二者的主要鉴别点,颈椎屈曲位和中立位MRI也有助于二者的鉴别。目前CSA合并平山病的相关报道较少[15],但仍需提高警惕[16]。
CSA治疗措施包括非手术治疗和手术治疗。非手术治疗包括急性期使用前列腺素、高压氧、颈椎制动等[1]。研究显示术前肌肉萎缩时间、术前MMT分级及CSA类型是评估术后疗效的重要因素,病史越长、MMT分级越低术后恢复程度越差[1, 17]。Fujiwara等[8]研究显示92%的近端型CSA术后肌力得到恢复改善,而远端型仅38%术后肌力改善。大量研究结果显示[1, 8, 18]远端型CSA术后效果较近端型CSA差,是手术效果不良的危险因素之一,认为AH细胞损伤是远端型CSA的主要发生机制,而AH细胞再生能力差于脊髓前根。总之,与近端型CSA相比,远端型CSA具有发生率低、术前病程长、椎管狭窄节段多、颈椎生理曲度差、T2像高信号多见、术后恢复慢及手术效果差等特点[8]。学者对CSA做了大量的研究,但目前有关手术时机和手术方式的选择尚未达成一致意见。前路减压融合术和单纯的后路椎管成形术(或后路椎管成形术联合椎间孔切开术)在CSA中均有报道。前路手术有利于解除前侧及前外侧的压迫损伤,尤其是椎间孔入口处的压迫及超过2个节段的患者。后路手术属于间接减压(旷置前方压迫)治疗,但手术难度低于前路[1, 19],Fujiwara等[5]报道的后路术后优良率达到78%(25/32)。有报道建议对于1 ~ 2个节段的无椎管狭窄的患者行前路手术;而大于2个节段合并椎管狭窄的患者建议后路治疗,合并椎间孔狭窄者同时行椎间孔切开术[1, 19]。本病例患者年龄较大(60岁)、病史长(10年)、肌肉萎缩严重(大小鱼际肌萎缩、远端型)、颈椎曲度差(局部有反弓)、椎管狭窄节段多(3个节段)且脊髓高信号改变明显(“蛇眼征”),术后疗效差,符合典型的远端型CSA。此外,该患者曾因肌肉萎缩行“尺神经减压松解修复术”,延误了病情,影响治疗效果。
CSA的发生机制及治疗措施有待于进一步研究,同时临床医务工作者应提高对CSA的认识性及警惕性,减少漏诊、误诊,把握时机采取合适的治疗措施。远端型CSA患者的严重程度及治疗效果显著不如近端型患者,其病理机制及治疗方式、手术时机的选择有待进一步的探索与研究。
| [1] | Jiang SD, Jiang LS, Dai LY. Cervical spondylotic amyotrophy[J]. Eur Spine J, 2011, 20(3): 351–357. DOI:10.1007/s00586-010-1544-1 |
| [2] | Ciesla N, Dinglas V, Fan E, et al. Manual muscle testing:a method of measuring extremity muscle strength applied to critically ill patients[J]. J Vis Exp, 2011, 12(50): 2632. |
| [3] | Tashjian RZ, Hung M, Keener JD, et al. Determining the minimal clinically important difference for the American Shoulder and Elbow Surgeons score, Simple Shoulder Test, and visual analog scale(VAS) measuring pain after shoulder arthroplasty[J]. J Shoulder Elbow Surg, 2017, 26(1): 144–148. DOI:10.1016/j.jse.2016.06.007 |
| [4] | Keegan JJ. The cause of dissociated motor loss in the upper extremity with cervical spondylosis[J]. J Neurosurg, 1965, 23(5): 528–536. DOI:10.3171/jns.1965.23.5.0528 |
| [5] | Shinomiya K, Komori H, Matsuoka T, et al. Neuroradiologic and electrophysiologic assessment of cervical spondylotic amyotrophy[J]. Spine(Phila Pa 1976), 1994, 19(1): 21–25. DOI:10.1097/00007632-199401000-00005 |
| [6] | Kameyama T, Ando T, Yanagi T, et al. Cervical spondylotic amyotrophy. Magnetic resonance imaging demonstration of intrinsic cord pathology[J]. Spine(Phila Pa 1976), 1998, 23(4): 448–452. DOI:10.1097/00007632-199802150-00008 |
| [7] | Shibuya R, Yonenobu K, Yamamoto K, et al. Acute arm paresis with cervical spondylosis:three case reports[J]. Surg Neurol, 2005, 63(3): 220–228. DOI:10.1016/j.surneu.2004.04.023 |
| [8] | Fujiwara Y, Tanaka N, Fujimoto Y, et al. Surgical outcome of posterior decompression for cervical spondylosis with unilateral upper extremity amyotrophy[J]. Spine(Phila Pa 1976), 2006, 31(20): E728–732. DOI:10.1097/01.brs.0000240207.00747.82 |
| [9] | 陈世铮, 关骅, 洪毅, 等. 颈脊髓损伤患者感觉平面与运动平面的差异分析及临床意义[J]. 中国脊柱脊髓杂志, 2009, 19(9): 642–645. |
| [10] | Tauchi R, Imagama S, Inoh H, et al. Risk factors for a poor outcome following surgical treatment of cervical spondylotic amyotrophy:a multicenter study[J]. Eur Spine J, 2013, 22(1): 156–161. DOI:10.1007/s00586-012-2506-6 |
| [11] | Jin X, Jiang JY, Lu FZ, et al. Electrophysiological differences between Hirayama disease, amyotrophic lateral sclerosis and cervical spondylotic amyotrophy[J]. BMC Musculoskelet Disord, 2014, 15: 349. DOI:10.1186/1471-2474-15-349 |
| [12] | Zhang JT, Yang DL, Shen Y, et al. Anterior decompression in the management of unilateral cervical spondylotic amyotrophy[J]. Orthopedics, 2012, 35(12): e1792–1797. DOI:10.3928/01477447-20121120-26 |
| [13] | Shinomiya K, Okawa A, Nakao K, et al. Morphology of C5 ventral nerve rootlets as part of dissociated motor loss of deltoid muscle[J]. Spine(Phila Pa 1976), 1994, 19(22): 2501–2504. |
| [14] | Kuwabara S, Sonoo M, Komori T, et al. Dissociated small hand muscle atrophy in amyotrophic lateral sclerosis:frequency, extent, and specificity[J]. Muscle Nerve, 2008, 37(4): 426–430. DOI:10.1002/mus.v37:4 |
| [15] | Zhang Z, Wang H. Is the"snake-eye"MRI sign correlated to anterior spinal artery occlusion on CT angiography in cervical spondylotic myelopathy and amyotrophy?[J]. Eur Spine J, 2014, 23(7): 1541–1547. DOI:10.1007/s00586-014-3348-1 |
| [16] | Hashiguchi S, Ogasawara N, Watanabe A, et al. Cervical spondylotic amyotrophy associated with Hirayama's disease[J]. Intern Med, 1997, 36(9): 647–650. DOI:10.2169/internalmedicine.36.647 |
| [17] | Tauchi R, Imagama S, Inoh H, et al. Appropriate timing of surgical intervention for the proximal type of cervical spondylotic amyotrophy[J]. Eur J Orthop Surg Traumatol, 2015, 25(Suppl 1): S107–113. |
| [18] | Inui Y, Miyamoto H, Sumi M, et al. Clinical outcomes and predictive factors relating to prognosis of conservative and surgical treatments for cervical spondylotic amyotrophy[J]. Spine(Phila Pa 1976), 2011, 36(10): 794–799. DOI:10.1097/BRS.0b013e3181e531a1 |
| [19] | Takebayashi T, Yoshimoto M, Ida K, et al. Minimum invasive posterior decompression for cervical spondylotic amyotrophy[J]. J Orthop Sci, 2013, 18(2): 205–207. DOI:10.1007/s00776-012-0330-9 |
 2017, Vol.15
2017, Vol.15  Issue(4): 254-257
Issue(4): 254-257


