2. 第二军医大学附属长征医院实验诊断科, 上海 200003
2. Department of Clinical Laboratory, Changzheng Hospital, Second Military Medical University, Shanghai 200003, China
腰痛是最常见的脊柱外科疾病,据统计,84%的人群一生中至少罹患一次腰痛[1],严重影响人类的身体健康及生活质量。椎间盘退行性疾病是引起腰痛最常见的原因之一,但椎间盘退行性变的机制尚不明确,相关研究表明炎性反应、细胞外基质的丢失、椎间盘细胞的死亡等在椎间盘的退行性变过程中起到了关键作用[2]。以往研究表明,发生退行性变的椎间盘组织内部细胞数量显著下降,而导致其数量下降的关键因素之一即是细胞凋亡[3]。因而,研究人员认为凋亡在椎间盘退行性变过程中发挥了重要作用。凋亡和自噬是细胞的2种程序性死亡方式,二者相互影响、相互作用,自噬可以促进或抑制细胞凋亡的发生[4]。生理条件下,在离体的未发生退行性变的成年大鼠髓核细胞和纤维环细胞内,可观察到低水平的自噬现象[5]。但在椎间盘退行性变过程中,尚未明确自噬的确切作用。
研究发现,多种细胞自噬与BCL2/腺病毒E1B19kDa相互作用蛋白3(BNIP3)表达相关,BNIP3在缺氧条件下可诱导细胞凋亡,但在缺血缺氧的早期,微管相关蛋白轻链3B(LC3B)可与BNIP3二聚体上的LC3B结合区域(LIR)相结合,从而促进线粒体自噬,发挥对组织的保护作用[6]。椎间盘发生退行性变与其所处的缺血缺氧环境相关,因此推测BNIP3与椎间盘的退行性变具有一定的相关性。为了更切合临床实际,本研究以人不同级别退行性变的椎间盘组织为研究对象,拟通过检测椎间盘组织中BNIP3和LC3B含量,结合相关细胞凋亡的检测,探讨二者在椎间盘退行性变中的表达变化及其意义,为椎间盘退行性变的治疗提供有效的理论指导。
1 资料与方法 1.1 研究对象与分组收集2016年4月—2016年7月因腰椎椎间盘突出症于本院脊柱外科进行手术治疗的21例患者的25个腰椎椎间盘标本,其中女11例13个标本,男10例12个标本;年龄13 ~ 80岁,中位年龄48岁。25个标本按照Pfirrmann分级标准[7]进行分组(n=5),各组患者性别组成差异无统计学意义;除Ⅰ级组年龄较小外,其余4组患者年龄差异无统计学意义(表 1)。有4例患者每例取了2个不同退行性变等级不同节段的椎间盘。所有受试人员均签署知情同意书,并经本院伦理委员会批准。
|
|
表 1 基本情况 Table 1 Basic conditions |
使用RNAiso Plus试剂提取组织总RNA,测定RNA含量,1%琼脂糖凝胶电泳观察所提取的总RNA纯度。用逆转录试剂盒将总RNA逆转录合成cDNA,然后进行荧光定量PCR反应。PCR引物序列见表 2。操作步骤和加样体系按实时荧光定量试剂盒说明进行。计算各实验组BNIP3、LC3B、Bcl-2、Bax及Casepase-3的mRNA相对表达量。
|
|
表 2 PCR引物序列 Table 2 Primer sequences |
用RIPA蛋白裂解液提取组织总蛋白,用BCA法测定蛋白浓度。取20 μL蛋白质样品进行SDS-PAGE电泳,然后将蛋白转至硝酸纤维素膜上,再用5%脱脂牛奶室温封闭1 h,加入一抗工作液(BNIP3 1:1 000,LC3B 1:1 000),4℃摇床孵育过夜;第2天加入HRP标记的二抗(1:1 000),室温摇床孵育1 h,加化学发光显色液,凝胶成像分析系统显色观察。
1.4 统计学处理应用SPSS 21.0软件对数据进行统计学分析。RT-PCR所测基因表达量及蛋白质印迹结果灰度值用x±s表示,组间差异的比较采用单因素方差分析;性别的组间差异比较采用χ2检验;年龄的组间差异比较采用非参数秩和检验。以P < 0.05为差异有统计学意义。
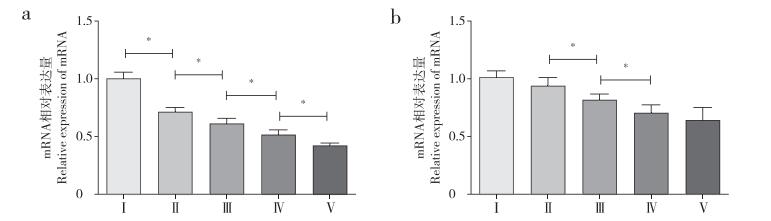
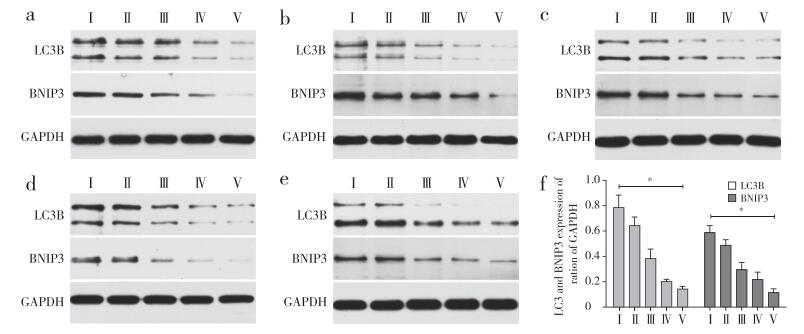
2 结果 2.1 BNIP3与LC3B的表达RT-PCR结果显示,随着椎间盘退行性变等级的增高,椎间盘中BNIP3与LC3B mRNA的相对表达量逐渐降低。其中BNIP3 mRNA在不同退行性变级别间差异均有统计学意义(P < 0.05,图 1a);LC3B mRNA相对表达量除在Ⅰ级与Ⅱ级、Ⅳ级与Ⅴ级之间差异无统计学意义(P > 0.05),其余各级之间差异均有统计学意义(P < 0.05,图 1b)。蛋白质印迹结果显示,随着椎间盘退行性变等级的增高,椎间盘中BNIP3和LC3B蛋白的相对表达量均呈下降趋势,与RT-PCR结果一致(图 2)。
|
a:BNIP3 b:LC3B * P < 0.05 图 1 各级退行性变椎间盘组织中BNIP3与LC3B的mRNA相对表达量 Figure 1 Relative expressions of BNIP3 and LC3B mRNAs in different Pfirrmann grading intervertebral disc tissuese |
|
a~e:25例样本f:各分级蛋白表达灰度值* P < 0.05 a-e:25 samples f:Average grey scale value of each grade * P < 0.05 图 2 各级退行性变椎间盘组织中BNIP3与LC3B的蛋白表达 Figure 2 Expressions of BNIP3 and LC3B proteins in different Pfirrmann grading intervertebral disc tissues |
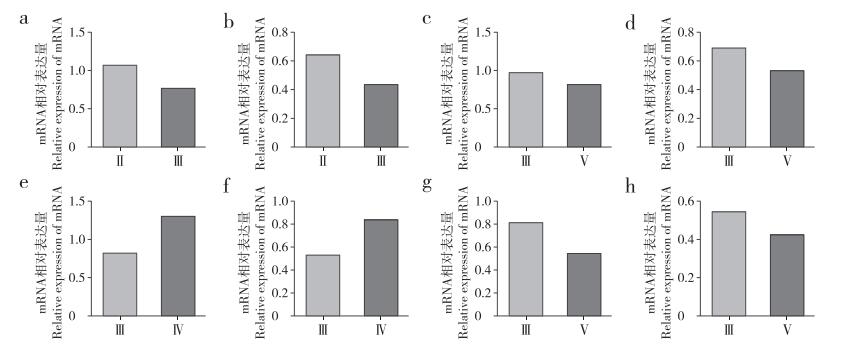
取自同一患者不同节段的椎间盘组织有4组。RT-PCR结果显示,其中3例患者的BNIP3与LC3B mRNA在高级别退行性变椎间盘组织中均表达较少,仅有1例(患者3)BNIP3与LC3B mRNA表达量在高级别退行性变椎间盘中表达较多(图 3)。蛋白质印迹结果显示,其中3例患者BNIP3与LC3B蛋白在高级别退行性变椎间盘组织中均低表达,与mRNA变化一致;1例(患者3)BNIP3蛋白在高级别退行性变椎间盘组织中高表达,与mRNA变化一致,而LC3B蛋白在高级别退行性变椎间盘组织中低表达,与mRNA变化结果相反(图 4)。
|
a:患者1 LC3B b:患者1 BNIP3 c:患者2 LC3B d:患者2 BNIP3 e:患者3 LC3B f:患者3 BNIP3 g:患者4 LC3B h:患者4 BNIP3 a:Patient 1 LC3B b:Patient 1 BNIP3 c:Patient 2 LC3B d:Patient 2 BNIP3 e:Patient 3 LC3B f:Patient 3 BNIP3 g:Patient 4 LC3B h:Patient 4 BNIP3 图 3 同一患者不同椎间盘LC3B与BNIP3 mRNA相对表达量 Figure 3 Relative expressions of LC3B and BNIP3 mRNAs in different intervertebral disc tissues from same patient |

|
图 4 同一患者不同椎间盘BNIP3与LC3B的蛋白表达 Figure 4 Expressions of BNIP3 and LC3B proteins in different intervertebral disc tissues from same patient |
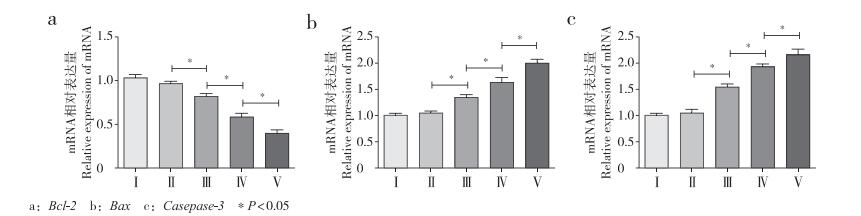
RT-PCR结果显示,随着椎间盘退行性变等级的增加,椎间盘中Bcl-2 mRNA的相对表达量逐渐降低,Bax及Casepase-3 mRNA的相对表达量逐渐增多,并且三者mRNA的表达量除在Ⅰ级与Ⅱ级间差异较小外,在其他级别之间差异均有统计学意义(P < 0.05,图 5)。
|
a:Bcl-2 b:Bax c:Casepase-3 * P < 0.05 图 5 各级退行性变椎间盘组织中Bcl-2、Bax及Casepase-3的mRNA相对表达量 Figure 5 Expressions of Bcl-2, Bax and Casepase-3 mRNA in different Pfirrmann grading intervertebral disc tissues |
细胞自噬在椎间盘退变过程中起到了重要作用,但对于椎间盘退行性变是促进作用还是抑制作用尚无定论[8]。研究发现,高级别退行性变椎间盘细胞中LC3含量明显低于低级别退行性变椎间盘细胞;同时,通过诱导细胞自噬减少细胞凋亡的作用在高级别退行性变椎间盘细胞中更为明显[9]。相关研究表明脊髓损伤后3 d,LC3水平达到高峰,之后随着时间的延长逐渐降低,且自噬水平也逐渐降低[10]。Jiang等[11]通过比较青年脊柱骨折患者椎间盘与中老年椎间盘退行性变患者椎间盘发现,高级别退行性变椎间盘中细胞自噬程度要低于低级别退行性变的椎间盘组织。本研究发现LC3B随椎间盘退行性变程度的增高而下降,这说明在体内环境下随着椎间盘退变的逐渐发生,髓核组织内的自噬水平在不断地降低,且本研究中Ⅱ、Ⅲ、Ⅳ、Ⅴ组人群年龄上差异无统计学意义,说明年龄在此过程中未形成显著影响,对于细胞自噬水平的影响主要来源于椎间盘的退变程度。本研究针对4例患者的不同病变节段的椎间盘组织样本检测结果进行分析,发现其中3例的检测结果与总体样本趋势相同,也在一定程度上说明在排除个体差异后,自噬水平与椎间盘退行性变程度呈负相关,这与Jiang等[11]的研究结果一致。
细胞凋亡又称细胞程序性死亡,是一种在无炎症产生的情况下,便可消除受损或者无用细胞的细胞死亡形式[12]。细胞凋亡可以导致椎间盘内部细胞的减少,是椎间盘退变的关键因素。许多因素可以导致椎间盘细胞凋亡,如氧化应激、营养缺乏、炎性因子刺激等[13]。细胞凋亡存在诸多信号通路,其中Bcl-2可以在相应信号途径中起到拮抗凋亡的作用,而Bax及Casepase-3起到促进凋亡的作用。诸多研究证明BNIP3具有诱导细胞凋亡的作用,但也有人在胶质瘤细胞、心肌细胞、骨骼肌细胞中发现了BNIP3诱导细胞自噬的现象[14-16]。本研究发现随着椎间盘退行性变程度的加重,髓核组织中的Bax和Casepase-3表达逐渐增加,Bcl-2逐渐减少,说明椎间盘退行性变程度越重,髓核细胞的凋亡水平越高;同时,LC3B及BNIP3的表达随椎间盘退变程度的加重而减少,提示在椎间盘退行性变的过程中BNIP3和LC3B与细胞自噬和凋亡均存在一定相关性,可能是细胞自噬和凋亡之间的桥梁蛋白。
人类椎间盘组织无血管供血,髓核细胞正常条件下处于缺血缺氧状态,有学者认为早期缺氧状态可诱导BNIP3表达,从而使细胞自噬来保护细胞以适应缺氧状态[17]。随着椎间盘退行性变的发生,血管神经长入椎间盘组织,增加了髓核细胞氧气、营养供应,抑制了BNIP3的表达。但也有学者认为,BNIP3对细胞的作用是双向的,其适度的激活可以诱导细胞自噬维持细胞生存,但过度的激活会导致细胞凋亡,其机制可能是随着缺氧时间的延长,缺氧程度的加重,活化的BNIP3导致LC3B的积累,自噬的过度发生导致细胞的凋亡[6]。本研究并未发现BNIP3和LC3B表达及细胞自噬和凋亡水平随椎间盘退行性变程度变化而产生峰值,这可能是由于Ⅰ级样本组织学上退行性变已经发生,细胞自噬对椎间盘起到保护作用,无加速退行性变的作用;随着椎间盘退行性变的逐渐加重,自噬水平逐渐降低,对椎间盘的保护作用也逐渐下降,因此如前文所述,在椎间盘退行性变晚期激活细胞自噬对椎间盘细胞保护效果更好[9]。
本研究通过对BNIP3及LC3B等基因在不同退行性变等级的人类椎间盘组织中的表达变化研究发现,随着椎间盘退行性变程度的加重,BNIP3与LC3B的表达减少,组织内细胞凋亡水平升高,细胞自噬对组织的保护作用逐渐下降。提示BNIP3与LC3B在腰椎椎间盘退行性变过程中具有重要的调节作用,可能是细胞自噬和凋亡之间的桥梁蛋白。但BNIP3在椎间盘退行性变过程中诱导自噬的具体机制及其如何在细胞凋亡和自噬之间起到相应调节作用尚需进一步研究探讨。深入研究BNIP3和LC3B在椎间盘退行性变过程中的作用机制可以为通过调节其水平起到延缓椎间盘退行性变的作用提供理论基础。
| [1] | Balagué F, Mannion AF, Pellisé F, et al. Non-specific low back pain[J]. Lancet, 2012, 379(9814): 482–491. DOI:10.1016/S0140-6736(11)60610-7 |
| [2] | Kadow T, Sowa G, Vo N, et al. Molecular basis of intervertebral disc degeneration and herniations:what are the important translational questions?[J]. Clin Orthop Relat Res, 2015, 473(6): 1903–1912. DOI:10.1007/s11999-014-3774-8 |
| [3] | Anderson DG, Tannoury C. Molecular pathogenic factors in symptomatic disc degeneration[J]. Spine J, 2005, 5(6 Suppl): 260–266. |
| [4] | Dang S, Yu ZM, Zhang CY, et al. Autophagy promotes apoptosis of mesenchymal stem cells under inflammatory microenvironment[J]. Stem Cell Res Ther, 2015, 6: 247. DOI:10.1186/s13287-015-0245-4 |
| [5] | Mizushima N, Yoshimori T, Ohsumi Y. The role of Atg proteins in autophagosome formation[J]. Annu Rev Cell Dev Biol, 2011, 27: 107–132. DOI:10.1146/annurev-cellbio-092910-154005 |
| [6] | Hanna RA, Quinsay MN, Orogo AM, et al. Microtubule-associated protein 1 light chain 3(LC3) interacts with Bnip3 protein to selectively remove endoplasmic reticulum and mitochondria via autophagy[J]. J Biol Chem, 2012, 287(23): 19094–19104. DOI:10.1074/jbc.M111.322933 |
| [7] | Pfirrmann CW, Metzdorf A, Zanetti M, et al. Magnetic resonance classification of lumbar intervertebral disc degeneration[J]. Spine(Phila Pa 1976), 2001, 26(17): 1873–1878. DOI:10.1097/00007632-200109010-00011 |
| [8] | Zhang SJ, Yang W, Wang C, et al. Autophagy:a double-edged sword in intervertebral disk degeneration[J]. Clin Chim Acta, 2016, 457: 27–35. DOI:10.1016/j.cca.2016.03.016 |
| [9] | Miyazaki S, Kakutani K, Yurube T, et al. Recombinant human SIRT1 protects against nutrient deprivation-induced mitochondrial apoptosis through autophagy induction in human intervertebral disc nucleus pulposus cells[J]. Arthritis Res Ther, 2015, 17: 253. DOI:10.1186/s13075-015-0763-6 |
| [10] | Kanno H, Ozawa H, Sekiguchi A, et al. Induction of autophagy and autophagic cell death in damaged neural tissue after acute spinal cord injury in mice[J]. Spine(Phila Pa 1976), 2011, 36(22): E1427–1434. DOI:10.1097/BRS.0b013e3182028c3a |
| [11] | Jiang W, Zhang X, Hao J, et al. SIRT1 protects against apoptosis by promoting autophagy in degenerative human disc nucleus pulposus cells[J]. Sci Rep, 2014, 4: 7456. |
| [12] | Taylor RC, Cullen SP, Martin SJ. Apoptosis:controlled demolition at the cellular level[J]. Nat Rev Mol Cell Biol, 2008, 9(3): 231–241. DOI:10.1038/nrm2312 |
| [13] | Ding F, Shao ZW, Yang SH, et al. Role of mitochondrial pathway in compression-induced apoptosis of nucleus pulposus cells[J]. Apoptosis, 2012, 17(6): 579–590. DOI:10.1007/s10495-012-0708-3 |
| [14] | Daido S, Kanzawa T, Yamamoto A, et al. Pivotal role of the cell death factor BNIP3 in ceramide-induced autophagic cell death in malignant glioma cells[J]. Cancer Res, 2004, 64(12): 4286–4293. DOI:10.1158/0008-5472.CAN-03-3084 |
| [15] | Hamacher-Brady A, Brady NR, Logue SE, et al. Response to myocardial ischemia/reperfusion injury involves Bnip3 and autophagy[J]. Cell Death Differ, 2007, 14(1): 146–157. DOI:10.1038/sj.cdd.4401936 |
| [16] | Mammucari C, Milan G, Romanello V, et al. FoxO3 controls autophagy in skeletal muscle in vivo[J]. Cell Metab, 2007, 6(6): 458–471. DOI:10.1016/j.cmet.2007.11.001 |
| [17] | Mazure NM, Pouysségur J. Atypical BH3-domains of BNIP3 and BNIP3L lead to autophagy in hypoxia[J]. Autophagy, 2009, 5(6): 868–869. DOI:10.4161/auto.9042 |
 2017, Vol.15
2017, Vol.15  Issue(6): 351-356
Issue(6): 351-356


