下腰痛与椎间盘退行性变密切相关[1]。当前,早中期的非手术治疗和晚期的侵袭性手术是临床治疗椎间盘退行性变的经典手段,但目前没有一种有效方法能够完全修复发生退行性变的椎间盘[2]。近年来,生物材料装载干细胞移植技术修复发生退行性变的椎间盘成为国内外研究的热点。研究证实,具有形状记忆性质的弹性多孔明胶微支架在注射时具有完全恢复形变的特点,并且发现其具有良好的生物力学强度[3-4]。明胶微支架可以体外修饰间充质干细胞(MSC),在注射治疗时可以使细胞内蛋白多糖等基质成分明显增加,延长细胞在注射部位的存活时间[3, 5]。本研究将明胶微支架装载脂肪间充质干细胞(ADMSC)移植入椎间盘退行性变动物模型中,观察椎间盘修复效果,为其进一步的临床应用提供实验依据。
1 材料与方法 1.1 实验动物及主要试剂健康成年比格犬12只,年龄11~14个月,平均体质量12 kg,由温州医科大学动物实验中心提供(检疫合格证号20160151)。实验获得温州医科大学伦理委员会批准(WZMD-205)。DMEM/F12培养基购自美国Hyclone公司,慢病毒包装质粒购自上海生智科技公司,ELISA试剂盒购自上海柏慧康生物科技有限公司。
1.2 ADMSC提取和标记提取犬自体ADMSC,取第3代细胞用于后续实验。将细胞培养液吸除,换新鲜培养液,同时加入表达绿色荧光蛋白(GFP)的慢病毒(Luc-GFP)1 mL。将培养瓶置于37℃、5%CO2培养箱培养1 h后,吸去培养液,加入5 mL含10%胎牛血清的DMEM/F12培养液继续培养3 d,荧光显微镜下观察绿色荧光表达。
1.3 明胶微支架制备及与ADMSC复合培养使用计算机辅助技术软件制作微孔阵列图形,以聚甲基丙烯酸酯薄板为原料制作微孔模具板,等离子处理2 min。将明胶粉末配制成质量体积比为6%的溶液,在冰上(保证低温环境,防止室温成胶)加入0.3%戊二醛溶液使其充分混合,即配成微支架预聚物溶液。然后将溶液真空冷冻干燥形成多孔联通结构(-45℃,30 min)。形成的微支架浸泡于双蒸水中即可从模具板上脱出,使用70 μm漏网收集,然后用蒸馏水清洗并滤除多余水分。将微支架置于小皿中铺成薄层,二次冷冻。冷冻干燥后使用紫外线灭菌或环氧乙烷灭菌备用,每次收集600个微支架。将ADMSC和微支架在培养基中共培养,微支架可自动吸附ADMSC,检测后发现每次可吸附1 000个ADMSC[4]。采用电镜观察微支架装载干细胞的形态。
1.4 实验动物分组及模型建立术前对12只比格犬行腰椎X线片及MRI检查,排除脊柱疾病及椎间盘退行性变。每只犬椎间盘分为5组:对照组(L7/S1)、模型组(L3/L4)、干细胞组(L4/L5)、微支架组(L5/L6)、微支架装载干细胞组(L6/L7)。采用穿刺抽吸髓核组织法进行椎间盘造模[6]。动物麻醉后,经左侧腹膜外入路暴露L4 ~ 7横突,显露L3/L4/L5/L6/L7椎间盘,用18G穿刺针穿刺至深度约8 mm,用10 mL注射器负压抽吸,抽吸出少量胶冻状髓核组织。干细胞组、微支架组、微支架装载干细胞组分别用21G微量注射器加压注射ADMSC、微支架及微支架和ADMSC共培养物,注射后保持2 min再拔针(图 1)。伤口分层缝合后用无菌棉垫覆盖,常规饲养观察。手术后4、8、12、24周进行影像学检查,24周时处死所有犬,取髓核组织进行指标检测。
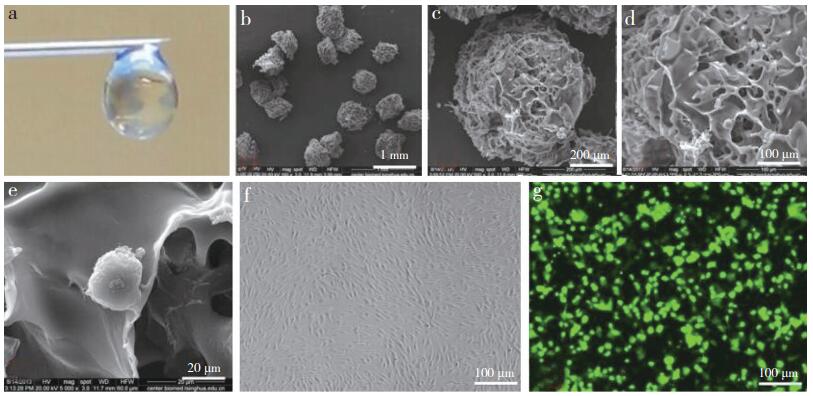
|
a:微支架通过21G微量注射器针头后,形态保持不变 b~d:明胶微支架的微观形貌e:微支架内黏附ADMSC f:ADMSC贴壁生长,呈梭形,均匀分布增长 g:荧光显微镜下可观察到Luc-GFP+-ADMSCs表达 a:Form of micro-scaffolds remains unchanged after injection through 21G syringe needle b-d:SEM images illustrating different sizes of macroporous morphology of micro-scaffolds e:ADMSC adhesion in micro-scaffolds f:ADMSCs grow adhering and liking spindle shape g:Expression of Luc-GFP+-ADMSCs under fluorescence microscope 图 1 微支架装载干细胞的形态和ADMSC标记结果 Figure 1 Morphology of ADMSCs loaded with micro-scaffolds and ADMSC labeling results |
应用CD manager软件,在侧位X线片上测量椎间盘相对高度(术后椎间盘高度与术前椎间盘高度的比值)[7]。用3.0 T MRI对腰椎椎间盘行矢状位扫描,测定相应椎间盘髓核及脑脊液的灰度值,以髓核灰度值与脑脊液灰度值的比值作为椎间盘相对灰度[7]。
1.6 椎间盘组织学检测取犬L3/L4/L5/L6/L7/S1椎间盘髓核组织,一部分进行冰冻荧光检测,一部分用甲醛溶液固定72 h后进行HE和番红O染色,另一部分用ELISA试剂盒检测软骨相关蛋白SOX-9、PG和COL2蛋白的含量。
1.7 统计学处理用SPSS 19.0软件对数据进行统计学分析,数据以x±s表示,采用单因素方差分析进行组间比较;以P < 0.05为差异有统计学意义。
2 结果 2.1 微支架装载干细胞的形态和ADMSC标记结果通过21G针头时,明胶微支架形态保持不变,均一悬浮在质量体积分数为0.5%的透明质酸水溶悬浮液中(图 1a)。电镜下可观察到圆柱状的微支架具有内部相互连通的大孔结构(图 1b~d),类圆形ADMSC包裹于其中(图 1e)。采用Luc-GFP慢病毒感染后,ADMSC生长状态良好,形态正常(图 1f);感染后第3天,在荧光显微镜下可观察到Luc-GFP+-ADMSCs表达(图 1g)。
2.2 移植后ADMSC存活情况及各组影像学结果24周时干细胞组和微支架装载干细胞组均可观察到少许Luc-GFP+-ADMSCs,微支架装载干细胞组可见更多的Luc-GFP+-ADMSCs(图 2a,b)。影像学检查结果(图 2c,d;表 1,2)显示,造模后4、8、12、24周,各组椎间盘相对高度和相对灰度持续降低,与对照组相比差异有统计学意义(P < 0.05);在8、12、24周时,微支架装载干细胞组椎间盘相对高度和相对灰度高于模型组、干细胞组和微支架组,差异有统计学意义(P < 0.05)。
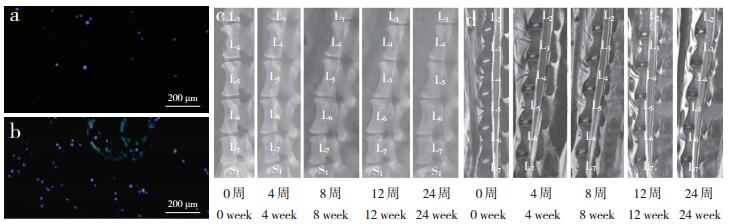
|
a:干细胞组Luc-GFP+-ADMSC表达 b:微支架装载干细胞组Luc-GFP+-ADMSC表达 c:X线片示椎间盘高度 d:MRI显示髓核亮度 a:Luc-GFP+-ADMSC expression in ADMSC group b:Luc-GFP+-ADMSC expression in micro-scaffold+ADMSC group c:Roentgenograph shows disc height d:MRI shows nucleus pulposus brightness 图 2 移植后ADMSC存活情况及各组影像学结果 Figure 2 ADMSCs survival after injection and imaging results of each group |
|
|
表 1 不同时间点各组椎间盘相对高度 Table 1 Disc relative height of each groups at different time points |
|
|
表 2 不同时间点各组椎间盘相对灰度 Table 2 Disc relative gray of each groups at different time points |
24周时,HE染色示模型组退行性变严重,微支架装载干细胞组、微支架组及干细胞组髓核发生中度退行性变,其中微支架装载干细胞组椎间盘退行性变程度较模型组、干细胞组和微支架组轻;番红O染色示微支架装载干细胞组、微支架组及干细胞组基质均较模型组增多,其中微支架装载干细胞组基质较干细胞组增多;大体标本示模型组和微支架组髓核发生严重退行性变(图 3)。

|
图 3 各组髓核组织学检查结果 Figure 3 Histological results of nucleus pulposus in each group |
ELISA检测结果显示,与对照组对比,其他各组髓核中软骨相关蛋白SOX-9、PG和COL2含量均降低,差异有统计学意义(P < 0.05,表 3);其中模型组最低,与干细胞组、微支架组和微支架装载干细胞组相比差异均有统计学意义(P < 0.05,表 3);微支架装载干细胞组高于模型组、干细胞组和微支架组,差异有统计学意义(P < 0.05,表 3)。
|
|
表 3 24周时各组SOX9、PG和COL2的含量 Table 3 Content of SOX9, PG and COL2 at 24 weeks in each group |
微支架作为一种新型的细胞载体材料备受关注。研究证实,微支架具有良好的生物相容性、低免疫原性、较强的机械性能及良好的多孔连通性与气液传递性,并且具有类似海绵的形状记忆特性,即使在极度压缩变形后仍可恢复原形,使得其通过微创注射的方式进行细胞治疗成为可能[8]。毛晓晶等[9]将明胶微支架与干细胞复合培养后发现,干细胞可保持较高活性,成脂成骨分化相关基因表达水平较二维诱导环境高。本研究采用前期报道的一种新型明胶微支架[8, 10],通过微加工的工程方法制备微孔模具,低温成胶。这种微支架可以达到微米级别,是机械性能良好的细胞运载工具,而且通过适当加压可以促进细胞的软骨分化,在细胞治疗领域有其独特优势和潜在应用价值[10]。
干细胞再生医学的发展为椎间盘退行性变的治疗带来了新的希望[11]。但是由于髓核组织内压力过大,注射的干细胞悬液容易通过注射针孔反流而产生不良反应,如形成骨赘等引起额外的疼痛[12];而且发生退行性变的髓核组织内环境恶劣,注入的干细胞可能大部分无法耐受而凋亡。本研究采用的微支架材料具有干细胞保护功能,并且采用21G注射器抽吸髓核组织,与既往研究采用的18G注射器[6]相比,更能减少纤维环的损伤。有学者采用胶原蛋白的纤维环塞解决细胞渗漏问题,但实际上并未达到预期效果[13]。本研究观察到在第24周时干细胞组运动节段周围的组织纤维包块比较明显,与以往的研究结果类似。但该现象在微支架装载干细胞组并没有发现,分析原因可能是发生退行性变的纤维环也可以进行部分修复,通过微小注射器最大程度减少对纤维环的破坏;并且,预成胶的明胶微支架占据了内部空间,当针头从组织中拔出时立刻堵住针孔,有效防止了渗漏。当然,也可能与本研究采用的细胞量较少有关;注射的明胶微支架和针头的尺寸也与此有关。
本研究采用犬椎间盘退行性变模型,经影像学、组织学及分子生物学结果证实,采用微支架装载干细胞能够更好地延缓椎间盘的退行性变。分析其原因:①微支架保护干细胞免受注射过程和退行性变环境的损伤;②微支架促进干细胞存留;③微支架内的微环境调节干细胞成软骨分化;④微支架的机械性能有助于干细胞承受高内压。然而,结果发现椎间盘的恢复程度仍然有限,可能因为采用的模型椎间盘退行性变严重;而且,为了注射更多的微支架和干细胞,本研究吸出了比其他研究更多的髓核组织[(25.0±5.1)mg vs.(16.6±3.5)mg[6]]。单纯微支架组也表现出一定的治疗效果,可能是因为微支架能为发生退行性变的椎间盘提供机械支撑从而降低退变速度。
微支架可随时间逐渐降解[10]。本研究发现微支架组在治疗后24周时髓核组织中无微支架网状结构(图 3),说明微支架可能在高压环境下发生了降解。微支架辅助性策略在细胞渗漏与承载压力方面起到重要作用,但仍需提高该材料长期维持功能的效果。
既往研究发现MSC在移植入髓核后发生分化[14],也有研究认为MSC不能在发生退行性变的环境中存活[15]。本研究未观察到ADMSC的长期增殖,也许与低剂量注射和退行性变程度较重有关,Luc-GFP表达降低可能也是另一个原因。本研究发现干细胞的确能够改善椎间盘退行性变,但由于24周时只有少量的细胞,没有观察到干细胞的具体转归。今后将进一步探索细胞转归以明确ADMSC的作用机制。
综上所述,本研究通过24周的观察,发现明胶微支架装载ADMSC移植可延缓比格犬椎间盘退行性变,有望为发生退行性变的椎间盘组织的修复治疗提供新的策略。今后仍有必要进行更长期的观察,以进一步明确微支架装载干细胞对椎间盘退行性变的疗效,而且,对于明胶材料的改进及细胞的转归仍有待于进一步探索。
| [1] | Petrofsky JS, Laymon M, Alshammari F, et al. Use of low level of continuous heat and Ibuprofen as an adjunct to physical therapy improves pain relief, range of motion and the compliance for home exercise in patients with nonspecific neck pain:a randomized controlled tria[J]. J Back Musculoskelet Rehabil, 2017, 30(4): 889–896. DOI:10.3233/BMR-160577 |
| [2] | 李超, 阮狄克, 何勍, 等. 腰椎后外侧融合术对已存在退变的相邻节段的中远期影响[J]. 脊柱外科杂志, 2017, 15(3): 150–155. DOI:10.3969/j.issn.1672-2957.2017.03.005 |
| [3] | Bencherif SA, Sands RW, Bhatta D, et al. Injectable preformed scaffolds with shape-memory properties[J]. Proc Natl Acad Sci USA, 2012, 109(48): 19590–19595. DOI:10.1073/pnas.1211516109 |
| [4] | Liu W, Li Y, Zeng Y, et al. Microcryogels as injectable 3-D cellular microniches for site-directed and augmented cell delivery[J]. Acta Biomater, 2014, 10(5): 1864–1875. DOI:10.1016/j.actbio.2013.12.008 |
| [5] | Wu RC, Zeng Y, Chen YF, et al. Temporal-spatial establishment of initial niche for the primary spermatogonial stem cell formation is determined by an ARID4B regulatory network[J]. Stem Cells, 2017, 35(6): 1554–1565. DOI:10.1002/stem.2597 |
| [6] | Hiyama A, Mochida J, Iwashina T, et al. Transplantation of mesenchymal stem cells in a canine disc degeneration mode[J]. J Orthop Res, 2008, 26(5): 589–600. DOI:10.1002/(ISSN)1554-527X |
| [7] | Lü DS, Shono Y, Oda I, et al. Effects of chondroitinase ABC and chymopapain on spinal motion segment biomechanics. An in vivo biomechanical, radiologic, and histologic canine study[J]. Spine (Phila Pa 1976), 1997, 22(16): 1828–1834. DOI:10.1097/00007632-199708150-00006 |
| [8] | Li Y, Liu W, Liu F, et al. Primed 3D injectable microniches enabling low-dosage cell therapy for critical limb ischemia[J]. Proc Natl Acad Sci USA, 2014, 111(37): 13511–13516. DOI:10.1073/pnas.1411295111 |
| [9] | 毛晓晶, 曾洋, 韩钦, 等. 明胶微冰胶支架有利于脂肪来源间充质干细胞体外干性维持并提高其体内应用价值[J]. 基础医学与临床, 2015, 35(5): 610–614. |
| [10] | Zeng Y, Zhu L, Han Q, et al. Preformed gelatin microcryogels as injectable cell carriers for enhanced skin wound healing[J]. Acta Biomater, 2015, 25: 291–303. DOI:10.1016/j.actbio.2015.07.042 |
| [11] | 侯洋, 史建刚, 袁文. 骨形态发生蛋白2和富血小板血浆凝胶对兔骨髓间充质干细胞体外成软骨分化的影响[J]. 脊柱外科杂志, 2016, 14(6): 356–361. DOI:10.3969/j.issn.1672-2957.2016.06.008 |
| [12] | Vadalà G, Sowa G, Hubert M, et al. Mesenchymal stem cells injection in degenerated intervertebral disc:cell leakage may induce osteophyte formation[J]. J Tissue Eng Regen Med, 2012, 6(5): 348–355. DOI:10.1002/term.v6.5 |
| [13] | Chik TK, Ma XY, Choy TH, et al. Photochemically crosslinked collagen annulus plug:a potential solution solving the leakage problem of cell-based therapies for disc degeneration[J]. Acta Biomater, 2013, 9(9): 8128–8139. DOI:10.1016/j.actbio.2013.05.034 |
| [14] | Sakai D, Mochida J, Iwashina T, et al. Differentiation of mesenchymal stem cells transplanted to a rabbit degenerative disc model:potential and limitations for stem cell therapy in disc regeneration[J]. Spine (Phila Pa 1976), 2005, 30(21): 2379–2387. DOI:10.1097/01.brs.0000184365.28481.e3 |
| [15] | Hoogendoorn RJ, Lu ZF, Kroeze RJ, et al. Adipose stem cells for intervertebral disc regeneration:current status and concepts for the future[J]. J Cell Mol Med, 2008, 12(6A): 2205–2216. DOI:10.1111/j.1582-4934.2008.00291.x |
 2019, Vol.17
2019, Vol.17  Issue(2): 110-115, 139
Issue(2): 110-115, 139


