2. 解放军联勤保障部队940医院骨科, 兰州 730070
2. Department of Orthopaedics, No. 940 Hospital of PLA Joint Logistic Support Force, Lanzhou 730070, Gansu, China
椎间盘退行性疾病可引起疼痛、神经损伤以及劳动力丧失,给社会带来沉重的负担[1-2]。椎间盘退行性变可导致蛋白聚糖的丢失、细胞外基质结构的破坏、纤维环的撕裂、髓核的突出以及椎间隙高度的丢失[3]。纤维环无血管及神经,细胞的自我修复能力很差[4],一点小的撕裂或裂缝就可能逐渐发展,引起髓核突出或者被椎间盘碎片取代形成瘢痕;外科手术可以清除游离的纤维环碎片和髓核,但是撕裂的纤维环得不到有效修复,可能引起复发或出现继发病变[5-7]。因此,有效修复纤维环具有重要的临床意义。
组织工程技术为纤维环修复提供了新思路,如何根据纤维环复杂的结构和力学特点构建“仿生”生物支架是研究的难点。纤维环所受应力复杂,内部胶原纤维高度取向、交织排列,具有明显各向异性的力学特点。为了模拟该特点,本研究通过多层结合的方法,采用静电纺丝技术制备了取向纳米纤维支架(AFS)、取向纳米纱支架(AYS)和三维多孔纳米纤维支架(3DPS),并通过体内外实验评价3种支架的生物相容性,为进一步的体内实验奠定基础。
1 材料与方法 1.1 主要材料DMEM细胞培养基(Hyclone公司,美国)、胎牛血清(Gibco公司,美国);CCK-8试剂盒(Dojindo研究所,日本);明胶、聚左旋乳酸(PLLA)和聚己内酯(PCL)由东华大学提供。倒置显微镜(Olympus公司,日本);扫描电子显微镜(SEM,飞利浦公司,荷兰);FL800酶标仪(Bio-Tek公司,美国)。SD大鼠骨髓间充质干细胞(BMSC)由海军军医大学基础医学院解剖学教研室提供。6周龄雄性SD大鼠24只,体质量约为200 g,购自上海西普尔-必凯实验动物有限公司,实验动物生产许可证号为SCXK(沪)2018-0006。
1.2 支架制备将PLLA/PCL和明胶按质量比8:2配制成完全透明的溶液,加入注射器中,注射器针头与直流电高压发生器相连(电压12 kV),用微量注射泵控制溶液的推进速度(1.5 mL/h),采用高速滚轴作为接收装置,使用共轭静电纺丝技术制备AYS。将PLLA和明胶按质量比2:8配制成溶液,采用常规静电纺丝技术制作无规纳米纤维(电压12 kV,流速2.5 mL/h),通过改变接收装置,制备AFS。将无规纳米纤维膜剪碎,加入叔丁醇溶液,匀浆打碎,冷冻干燥后成形制成3DPS。将制备的3种支架喷金后采用SEM观察支架形态特征。
1.3 体外生物相容性评价将3种支架采用60Co辐照消毒后置于24孔板中,使用含10%胎牛血清的低糖DMEM培养基孵育过夜。采用CCK-8试剂盒检测支架中细胞黏附和增殖情况。将第3代BMSC按1×105/孔接种至预置支架的24孔板中,加入含10%胎牛血清的完全培养基,置于37℃、5%CO2细胞培养箱中培养。分别于培养2、4、8、16 h后去除培养基,PBS轻柔清洗2遍,加入含10%体积CCK-8试剂的无血清培养基继续孵育2 h,随后从每孔培养液中吸取100 μL溶液加入96孔板中,用酶标仪检测450 nm处的光密度(OD)值,每个浓度梯度设置5个复孔取平均值,OD值即反映支架中黏附细胞数目。同法检测细胞在支架中培养1、3、7 d时的增殖情况。7 d后取出支架,固定、脱水、喷金后用SEM观察细胞形态及生长情况。
1.4 体内生物相容性评价将3种支架切割成直径约为8 mm的圆盘形,消毒灭菌。SD大鼠麻醉后在背部椎旁1 cm对称做长约1 cm纵行切口,钝性分离皮下组织形成“皮袋”,每只大鼠制作3个“皮袋”,将3种支架分别随机选择一个“皮袋”植入。术后大鼠生命体征平稳,无死亡,苏醒后活动自如,常规饲养,切口愈合良好,无红肿、破溃,1周后拆线。术后1、2、4、8、12、24周,每个时间点随机选取3只大鼠,取出支架进行检测。采用HE染色观察支架形态、炎性细胞长入情况、细胞密度和巨噬细胞融合情况;提取RNA,利用实时荧光定量聚合酶链式反应(FQ-PCR)检测白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、IL-10、转化生长因子-β(TGF-β)基因相对表达水平。
1.5 统计学处理采用SPSS 17.0软件对数据进行统计学分析。计量资料以x±s表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验;计数资料以例数和百分数(%)表示,组间比较采用χ2检验;以P < 0.05为差异有统计学意义。
2 结果 2.1 支架的形态学观察AFS具有较好的取向性,纤维直径均匀,孔隙较为致密(图 1a);AYS同样具有良好的取向性,由高度有序排列的纳米纱纤维和少部分散在的纳米纤维构成,纤维之间相互连接,其纤维排列取向性较AFS更佳,具有更高的孔隙率(图 1b);3DPS排列杂乱无章,但较AFS和AYS具有更高的孔径及孔隙率(图 1c,d)。

|
a:AFS b:AYS c, d:3DPS 图 1 支架材料的结构(SEM) Figure 1 Structures of scaffold materials(SEM) |
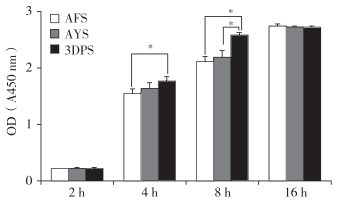
BMSC和支架共培养2、4、8、16 h后,3种支架细胞黏附量随时间延长增加。4 h时AFS与AYS、AYS与3DPS的细胞黏附量差异无统计学意义(P > 0.05,图 2)。3DPS的细胞黏附量高于AFS且差异具有统计学意义(P < 0.05,图 2)。8 h时3DPS的细胞黏附量高于AFS和AYS,差异有统计学意义(P < 0.05,图 2)。16 h时3种支架的细胞黏附量差异均无统计学意义(P > 0.05,图 2)。
|
注:* P < 0.05 Note:* P < 0.05 图 2 细胞黏附情况 Figure 2 Cell adhesion |
BMSC和支架共培养1、3、7 d后,3种支架细胞增殖量随时间延长而增加。1 d时AFS的细胞增殖量与AYS差异无统计学意义(P > 0.05),而3DPS的细胞增殖量低于AFS和AYS且差异有统计学意义(P < 0.05,图 3)。3 d时AFS的细胞增殖量与AYS差异无统计学意义(P > 0.05),而3DPS的细胞增殖量高于AFS且差异有统计学意义(P < 0.05,图 3),3DPS的细胞增殖量与AYS差异无统计学意义(P > 0.05)。7 d时AFS的细胞增殖量与AYS差异仍无统计学意义(P > 0.05),而3DPS的细胞增殖量高于AFS和AYS且差异有统计学意义(P < 0.05,图 3)。

|
注:* P < 0.05 Note:* P < 0.05 图 3 细胞增殖情况 Figure 3 Cell growth |
BMSC和支架共培养7 d后,SEM观察可见BMSC在3种支架表面贴附牢固,生长状态良好。在AFS和AYS上细胞随纤维方向生长呈现长梭形,伸展充分(图 4a,b);在3DPS上细胞多呈圆形,还可观察到细胞向支架材料内部长入(图 4c)。

|
a:AFS b:AYS c:3DPS 图 4 细胞形态(SEM) Figure 4 Cell morphology(SEM) |
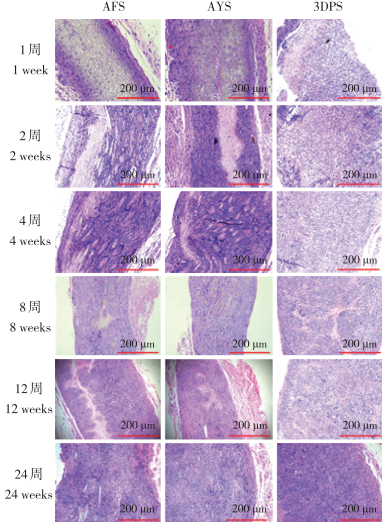
支架植入大鼠皮下1周时,AFS表层炎性细胞多,AYS有部分炎性细胞浸润,3DPS炎性细胞浸润较为均匀;2周后3种支架均有炎性细胞浸润,细胞数量显著增多,达到高峰;4周时3种支架上炎性细胞聚集成簇;8周、12周时3种支架材料上炎性细胞数量均减少,部分材料吸收;24周时可见散在的炎细胞浸润,材料稀疏(图 5)。
|
图 5 支架植入大鼠体内后的炎性反应(HE染色) Figure 5 Inflammatory response of scaffolds in vivo (HE staining) |
支架植入大鼠皮下1周时,AFS、AYS表层炎性细胞多,有零星异物巨噬细胞,3DPS以炎性细胞浸润为主,罕见异物巨细胞;2周、4周时3种支架上均可见异物巨细胞,且AFS、AYS上异物巨细胞显著增多,巨噬细胞聚集、融合成簇,达到高峰,3DPS上异物细胞相对较少;8周时3种支架上炎性细胞和异物巨细胞数量均减少(图 6)。

|
图 6 支架植入大鼠体内后的异物巨细胞形态(HE染色) Figure 6 Foreign body giant cells morphology of scaffolds in vivo(HE staining) |
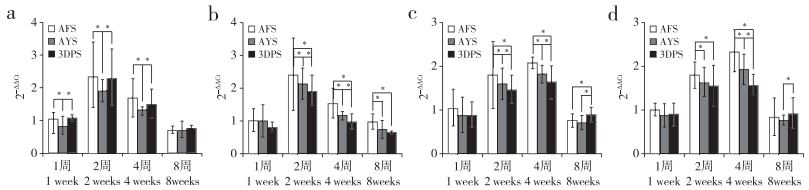
支架植入大鼠皮下1周时,3种支架中IL-6、TNF-α、IL-10、TGF-β基因总体表达量均不高,AFS、3DPS中IL-6基因表达量较AYS高,差异具有统计学意义(P < 0.05,图 7a)。2周时3种支架中IL-6、TNF-α、IL-10、TGF-β基因表达量均升高,AFS与3DPS的IL-6基因表达量均较AYS高,差异具有统计学意义(P < 0.05,图 7a);TNF-α、IL-10、TGF-β基因表达量总体呈AFS > AYS > 3DPS(图 7b~d)。4周时3种支架中IL-6、TNF-α基因表达量明显回落;IL-10、TGF-β基因表达量持续升高达峰值,总体趋势仍呈AFS > AYS > 3DPS 3种支架周表达量差异均有统计学意义(P < 0.05,图 7c,d)。8周时IL-6、TNF-α、IL-10、TGF-β基因表达量均明显回落(图 7)。
|
a:IL-6 b:TNF-α c:IL-10 d:TGF-β * P < 0.05 图 7 炎性因子基因表达 Figure 7 Gene expression of inflammatory factors |
一种合适的纤维环组织工程支架首先需具有良好的生物相容性,将细胞与支架共培养后观察细胞在支架上的黏附、增殖及生长状态是评估支架体外生物相容性的常用方法。本研究结果显示,细胞在3种支架上均良好黏附、增殖,其中在3DPS上细胞黏附率(4、8、16 h)和增殖率(3、7 d)均高于AFS和AYS。SEM观察发现,BMSC在3种支架表面黏附牢固,生长状态良好,且在3DPS上还可观察到细胞向支架内部长入的现象。
支架的生物相容性是支架植入后宿主生理环境和一系列复杂生物、免疫反应的综合结果[8],因此,单纯的体外评价并不能准确评估支架的生物相容性,还需要应用动物体内实验来全面评估[9-10]。支架植入体内后首先被巨噬细胞识别,并黏附于支架表面与其发生相互作用,发生无菌性炎性反应,巨噬细胞与支架逐渐相互融合形成异物巨细胞,因此,巨噬细胞和异物巨细胞是判断支架生物相容性的重要因素[11]。本研究组织学检测结果表明,3种支架植入大鼠皮下均产生了一定程度的炎性反应,但无皮肤破溃、坏死等明显排斥反应。
本研究还观察了3种支架植入大鼠皮下后炎性因子的表达变化。有研究表明,IL-6、TNF-α通过细胞激活和趋化促进巨噬细胞浸润而促进炎性反应,而IL-10、TGF-β则被认为是抗炎因子[12-16]。细胞因子在支架植入早期(通常在第1周)即产生并激活,而且是判断针对异物纤维修复预后的重要预测因素[17-19]。起初血清蛋白、中性粒细胞、单核细胞聚集包裹在支架周边,并激活大量的巨噬细胞黏附于支架上,巨噬细胞分泌特有的细胞因子与支架结合,并成为促炎或抗炎因子的主要来源[20-21]。通常认为IL-6、TNF-α于急性炎性反应早期出现,在常规伤口愈合过程中,IL-6在伤后1 d开始升高,3 d达到高峰,10 d后回归正常[22]。本研究发现支架植入大鼠皮下后,这种炎性反应的发生明显推迟,IL-6、TNF-α呈缓慢升高趋势,2周达到高峰,4周后逐渐回落,8周后趋于正常;而IL-10、TGF-β持续升高。炎性因子的表达与组织学检测结果吻合,证实3种支架均可引起轻度慢性炎性反应。
综上,BMSC在AYS和3DPS上增殖、分化良好,且可长入3DPS内部;支架周围组织炎性反应小,提示AYS和3DPS生物相容性良好,为进一步采用AYS仿生外层纤维环、3DPS仿生内层纤维环,两层胶联制成复合支架构建仿生组织工程纤维环奠定基础。
| [1] |
Murray CJ, Atkinson C, Bhalla K, et al. The state of US health, 1990-2010:burden of diseases, injuries, and risk factors[J]. JAMA, 2013, 310(6): 591-608. DOI:10.1001/jama.2013.13805 |
| [2] |
Murray CJ, Lopez AD. Measuring the global burden of disease[J]. N Engl J Med, 2013, 369(5): 448-457. DOI:10.1056/NEJMra1201534 |
| [3] |
Boos N, Weissbach S, Rohrbach H, et al. Classification of age-related changes in lumbar intervertebral discs:2002 Volvo Award in basic science[J]. Spine(Phila Pa 1976), 2002, 27(23): 2631-2644. |
| [4] |
Roberts S, Urban JP, Evans H, et al. Transport properties of the human cartilage endplate in relation to its composition and calcification[J]. Spine(Phila Pa 1976), 1996, 21(4): 415-420. DOI:10.1097/00007632-199602150-00003 |
| [5] |
Guterl CC, See EY, Blanquer SB, et al. Challenges and strategies in the repair of ruptured annulus fibrosus[J]. Eur Cell Mater, 2013, 25: 1-21. DOI:10.22203/eCM |
| [6] |
Carragee EJ, Spinnickie AO, Alamin TF, et al. A prospective controlled study of limited versus subtotal posterior discectomy:short-term outcomes in patients with herniated lumbar intervertebral discs and large posterior anular defect[J]. Spine(Phila Pa 1976), 2006, 31(6): 653-657. DOI:10.1097/01.brs.0000203714.76250.68 |
| [7] |
McGirt MJ, Eustacchio S, Varga P, et al. A prospective cohort study of close interval computed tomography and magnetic resonance imaging after primary lumbar discectomy:factors associated with recurrent disc herniation and disc height loss[J]. Spine(Phila Pa 1976), 2009, 34(19): 2044-2051. DOI:10.1097/BRS.0b013e3181b34a9a |
| [8] |
Williams DF. On the mechanisms of biocompatibility[J]. Biomaterials, 2008, 29(20): 2941-2953. DOI:10.1016/j.biomaterials.2008.04.023 |
| [9] |
Kawahara H. Cellular responses to implant materials:biological, physical and chemical factors[J]. Int Dent J, 1983, 33(4): 350-375. |
| [10] |
Pearce AI, Richards RG, Milz S, et al. Animal models for implant biomaterial research in bone:a review[J]. Eur Cell Mater, 2007, 13: 1-10. DOI:10.22203/eCM |
| [11] |
Ji W, Yang F, Seyednejad H, et al. Biocompatibility and degradation characteristics of PLGA-based electrospun nanofibrous scaffolds with nanoapatite incorporation[J]. Biomaterials, 2012, 33(28): 6604-6614. DOI:10.1016/j.biomaterials.2012.06.018 |
| [12] |
Putra A, Ridwan FB, Putridewi AI, et al. The role of TNF-α induced MSCs on suppressive inflammation by increasing TGF-β and IL-10[J]. Open Access Maced J Med Sci, 2018, 6(10): 1779-1783. |
| [13] |
Luttikhuizen DT, Harmsen MC, Van Luyn MJ. Cellular and molecular dynamics in the foreign body reaction[J]. Tissue Eng, 2006, 12(7): 1955-1970. DOI:10.1089/ten.2006.12.1955 |
| [14] |
Wei H, Yin L, Feng S, et al. Dual-parallel inhibition of IL-10 and TGF-β1 controls LPS-induced inflammatory response via NF-κB signaling in grass carp monocytes/macrophages[J]. Fish Shellfish Immunol, 2015, 44(2): 445-452. DOI:10.1016/j.fsi.2015.03.023 |
| [15] |
Hang L, Kumar S, Blum AM, et al. Heligmosomoides polygyrus bakeri infection decreases Smad7 expression in intestinal CD4+ T cells, which allows TGF-β to induce IL-10-producing regulatory T cells that block colitis[J]. J Immunol, 2019, ji1801392. |
| [16] |
Molnarfi N, Bjarnadóttir K, Benkhoucha M, et al. Activation of human B cells negatively regulates TGF-β1 production[J]. J Neuroinflammation, 2017, 14(1): 13. DOI:10.1186/s12974-017-0798-5 |
| [17] |
Rodriguez A, Meyerson H, Anderson JM. Quantitative in vivo cytokine analysis at synthetic biomaterial implant sites[J]. J Biomed Mater Res A, 2009, 89(1): 152-159. |
| [18] |
Dipietro LA, Polverini PJ, Rahbe SM, et al. Modulation of JE/MCP-1 expression in dermal wound repair[J]. Am J Pathol, 1995, 146(4): 868-875. |
| [19] |
Dipietro LA, Reintjes MG, Low QE, et al. Modulation of macrophage recruitment into wounds by monocyte chemoattractant protein-1[J]. Wound Repair Regen, 2001, 9(1): 28-33. DOI:10.1046/j.1524-475x.2001.00028.x |
| [20] |
Gretzer C, Emanuelsson L, Liljensten E, et al. The inflammatory cell influx and cytokines changes during transition from acute inflammation to fibrous repair around implanted materials[J]. J Biomater Sci Polym Ed, 2006, 17(6): 669-687. DOI:10.1163/156856206777346340 |
| [21] |
Tang L, Hu W. Molecular determinants of biocompatibility[J]. Expert Rev Med Devices, 2005, 2(4): 493-500. DOI:10.1586/17434440.2.4.493 |
| [22] |
Brodbeck WG, Nakayama Y, Matsuda T, et al. Biomaterial surface chemistry dictates adherent monocyte/macrophage cytokine expression in vitro[J]. Cytokine, 2002, 18(6): 311-319. DOI:10.1006/cyto.2002.1048 |
 2019, Vol.17
2019, Vol.17  Issue(3): 198-202, 206
Issue(3): 198-202, 206


