脊髓缺血再灌注损伤是脊柱外科及胸腹主动脉手术时常见的并发症, 也是导致下肢瘫痪的重要因素, 严重威胁患者生存质量[1]。尽管手术、药物等治疗手段不断发展, 但仍不能有效预防或减少脊髓缺血再灌注损伤的发生[2]。脊髓缺血再灌注损伤涉及炎性反应、氧化应激等诸多机制[3]。腺苷酸活化蛋白激酶(AMPK)是一种异三聚体激酶, 作为能量感受器广泛存在于细胞中, 在调控细胞代谢平衡中发挥关键性作用, 与细胞增殖、凋亡、自噬、自由基平衡等过程密切相关[4]。本研究通过构建大鼠脊髓缺血再灌注损伤模型, 探讨AMPK在大鼠脊髓缺血再灌注损伤中的作用及可能的机制, 为脊髓缺血再灌注损伤的防治提供实验依据。
1 材料与方法 1.1 主要试剂和设备AMPK抑制剂Compound C购自美国Sigma公司, HE染色试剂盒购自上海碧云天生物技术有限公司, TUNEL细胞凋亡检测试剂盒购自上海信裕生物科技有限公司, BCA蛋白检测试剂盒购自美国BD公司, 兔抗大鼠AMPK、兔抗大鼠磷酸化AMPK(p-AMPK)、山羊抗鼠核转录因子κB(NF-κB)、兔抗大鼠核因子κB抑制蛋白α(IκBα)多克隆抗体均购自美国Santa Cruz公司, 山羊抗兔磷酸化IκBα(p-IκBα)多克隆抗体购自英国Abcam公司, 白细胞介素-1β(IL-1β)、IL-6和肿瘤坏死因子-α(TNF-α)ELISA检测试剂盒均购自南京森贝伽生物科技有限公司, 实时荧光定量PCR仪购自美国ABI公司, 凝胶电泳成像分析系统购自美国Bio-rad公司。
1.2 实验动物及分组清洁级成年健康雄性SD大鼠48只, 体质量220 ~ 250 g, 购自河南省实验动物中心[动物生产许可证号:SCXK(豫)2010-0002]。大鼠饲养于标准环境下, 自由进食和饮水, 适应性饲养7 d后, 利用随机数字表法分为假手术组、模型组、生理盐水组和AMPK抑制剂组, 每组12只。
1.3 脊髓缺血再灌注损伤模型建立参照文献[5]的方法制备大鼠脊髓缺血再灌注损伤模型。使用2.5%戊巴比妥钠腹腔注射麻醉大鼠, 取腹前正中切口, 逐层分离, 充分暴露腹主动脉; 游离腹主动脉, 于左肾动脉开口水平近心端用无创动脉夹夹闭, 同时夹闭左右髂总动脉分叉水平腹主动脉, 以双后肢出现发绀视为阻断成功; 60 min后去除动脉夹, 使血流恢复, 以双后肢复红视为再灌注成功。假手术组仅打开腹腔, 游离腹主动脉而不阻断。术后缝合切口, 预防性给予青霉素。AMPK抑制剂组大鼠建模前腹腔注射Compound C 20 mg/kg, 生理盐水组给予等量生理盐水。建模过程中各组均无大鼠死亡。
1.4 大鼠神经运动功能评估各组大鼠于建模后6、12、24和48 h时, 按照Basso、Beattie、Bresnahan(BBB)评分标准[6]对各组大鼠后肢运动情况进行评分。BBB评分由2位熟悉该评分标准的实验人员单独完成, 取均值。
1.5 HE染色法检测大鼠脊髓组织病理变化于末次脊髓运动功能评估后, 各组随机取6只大鼠麻醉处死, 留取L2~5脊髓组织。将脊髓组织用多聚甲醛固定后, 石蜡包埋, 切成厚度约4 μm的切片。切片60℃烤30 min, 用二甲苯水化15 min, 梯度乙醇脱蜡至水, 蒸馏水冲洗。用苏木精染色10 min, 流水冲洗后, 浸入1%盐酸乙醇中分化3 s, 再用流水冲洗25 min, 伊红染色60 s。经透明、脱水后, 用中性树脂封片, 在光学显微镜下观察。
1.6 TUNEL法检测各组大鼠脊髓组织中细胞凋亡取石蜡切片组织, 脱蜡, 用蛋白酶K消化60 min, 室温下用3%过氧化氢溶液孵育10 min以封闭内源性过氧化物酶。用PBS冲洗3次, 浸入11%的Triton X-100中冰浴5 min, 37℃下加入50 μL TUNEL反应液孵育60 min, 4℃下在湿盒中反应24 h。用PBS冲洗3次, 加入过氧化物酶于37℃反应30 min; 用PBS冲洗3次, 加入DAB反应10 min; 用PBS冲洗3次, 加入苏木精复染。经脱水、透明、封片等处理后, 于光学显微镜下观察。随机选取5个高倍视野, 计算细胞凋亡率(凋亡细胞占全部细胞的比例)。
1.7 蛋白质印迹法检测大鼠脊髓组织中AMPK、p-AMPK、NF-κB、IκBα和p-IκBα蛋白表达取新鲜脊髓组织, 研磨后加入细胞裂解液, 用总蛋白提取试剂盒获得细胞中总蛋白, 用BCA蛋白检测试剂盒检测蛋白纯度和浓度。取50 μg总蛋白, 进行SDS-聚丙烯酰胺凝胶电泳。将蛋白条带电转移至PVDF膜上, 用5%脱脂奶粉封闭120 min; 加入一抗兔抗大鼠AMPK、兔抗大鼠p-AMPK、山羊抗鼠NF-κB、兔抗大鼠IκBα和山羊抗兔p-IκBα多克隆抗体(稀释比例分别为1:500、1:1 200、1:800、1:2 000和1:1 000), 4℃孵育过夜; 加入二抗, 室温下反应120 min; TBST漂洗3次, 加入化学发光试剂暗室下反应20 min, 显影、拍照。利用Image J图像分析软件获取各条带灰度值, 以GAPDH为内参照, 计算目的蛋白的相对表达量。
1.8 ELISA法检测大鼠脊髓组织中IL-1β、IL-6和TNF-α浓度取新鲜脊髓组织, 研磨后, 加入PBS匀浆, 4℃条件下离心20 min(10 000 r/min, 离心半径10 cm), 留取上清, 利用ELISA法检测各组大鼠脊髓组织中IL-1β、IL-6和TNF-α浓度, 所有操作均在标准实验室按试剂盒说明完成。
1.9 统计学处理应用SPSS 21.0软件对数据进行统计学分析。计量资料以x±s表示, 多组间比较采用单因素方差分析, 两两比较采用LSD-q检验; 以P < 0.05为差异有统计学意义。
2 结果 2.1 各组大鼠神经运动功能的比较与假手术组相比, 模型组、生理盐水组和AMPK抑制剂组6、12、24和48 h时BBB评分均降低, 差异均有统计学意义(P < 0.05, 表 1); 与模型组和生理盐水组相比, AMPK抑制剂组6、12、24和48 h时BBB评分均升高, 差异均有统计学意义(P < 0.05, 表 1)。
|
|
表 1 大鼠神经运动功能评分(BBB评分) Table 1 Spinal motor function score(BBB score) of rats |
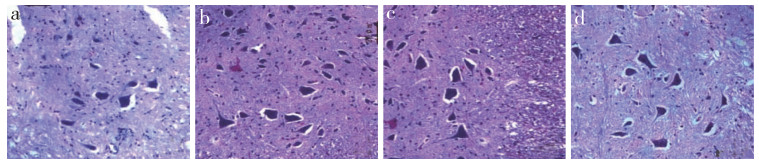
HE染色结果显示, 假手术组大鼠脊髓组织结构清晰完整, 神经元细胞核居中、完整, 呈椭圆或圆形(图 1a); 模型组和生理盐水组大鼠脊髓组织出现神经元变性、炎性细胞浸润, 细胞核固缩、溶解, 偶见凝血灶和出血, 有空泡形成(图 1b, c); AMPK抑制剂组大鼠脊髓组织中神经元细胞核形态基本正常, 坏死减少, 损伤程度较模型组和生理盐水组轻(图 1d)。
|
a:假手术组b:模型组c:生理盐水组d:AMPK抑制剂组 a:Sham group b:Model group c:Saline group d:AMPK inhibitor group 图 1 各组大鼠脊髓组织病理变化(HE染色, ×400) Figure 1 Pathological changes of spinal cord of rats in each group(HE staining, ×400) |
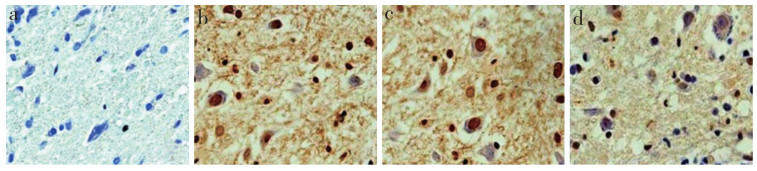
假手术组大鼠脊髓组织中未见神经元凋亡(图 2a); 模型组和生理盐水组大鼠脊髓组织中可见大量神经元凋亡(图 2b, c), 细胞凋亡率分别为(48.92±3.92)%和(50.14±4.05)%; AMPK抑制剂组大鼠脊髓组织中神经元凋亡减少(图 2d), 细胞凋亡率为(28.17±3.61)%。
|
a:假手术组b:模型组c:生理盐水组d:AMPK抑制剂组 a:Sham group b:Model group c:Saline group d:AMPK inhibitor group 图 2 各组大鼠脊髓组织中细胞凋亡情况(TUNEL染色, ×400) Figure 2 Cell apoptosis in spinal cord of rats in each group(TUNEL staining, ×400) |
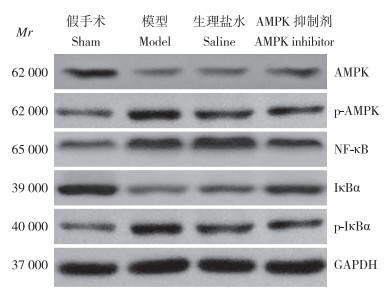
与假手术组相比, 模型组、生理盐水组和AMPK抑制剂组大鼠脊髓组织中p-AMPK、NF-κB和p-IκBα蛋白相对表达量均升高, 而AMPK和IκBα蛋白相对表达量均降低, 差异均有统计学意义(P < 0.05, 表 2, 图 3); 与模型组和生理盐水组相比, AMPK抑制剂组大鼠脊髓组织中p-AMPK、NF-κB和p-IκBα蛋白相对表达量均降低, 而AMPK和IκBα蛋白相对表达量均升高, 差异均有统计学意义(P < 0.05, 表 2, 图 3)。
|
|
表 2 各组大鼠脊髓组织中AMPK、p-AMPK、NF-κB、IκBα和p-IκBα蛋白相对表达量 Table 2 Relative expression of AMPK, p-AMPK, NF-κB, IκBα and p-IκBα proteins in spinal cord of rats in each group |
|
图 3 各组大鼠脊髓组织中AMPK、p-AMPK、NF-κB、IκBα和p-IκBα蛋白表达 Figure 3 Expressions of AMPK, p-AMPK, NF-κB, IκBα and p-IκBα proteins in spinal cord of rats in each group |
与假手术组相比, 模型组、生理盐水组和AMPK抑制剂组大鼠脊髓组织中IL-1β、IL-6和TNF-α浓度均升高, 差异均有统计学意义(P < 0.05, 表 3); 与模型组和生理盐水组相比, AMPK抑制剂组大鼠脊髓组织中IL-1β、IL-6和TNF-α浓度均降低, 差异均有统计学意义(P < 0.05, 表 3)。
|
|
表 3 各组大鼠脊髓组织中IL-1β、IL-6和TNF-α浓度 Table 3 Concentration of IL-1β, IL-6 and TNF-α in spinal cord of rats in each group |
脊髓缺血再灌注损伤作为临床上常见并发症, 可引起脊髓损伤平面以下运动、感觉障碍, 可导致尿失禁、性功能障碍等不可逆性损伤, 给患者生存质量带来严重威胁, 是目前临床研究的重点和难点[6]。AMPK是一种高度保守的丝/苏氨酸蛋白激酶, 在机体细胞能量代谢中发挥关键性作用[7], 在剧烈运动、营养不足、缺血、休克等应激条件下, 可直接调节机体能量代谢[8]。研究发现, AMPK可通过抑制炎性反应、保护内皮细胞功能等机制减轻肝脏、肾脏等器官缺血再灌注损伤[9-10]。但在脊髓缺血再灌注损伤中, 由于神经元缺少氧酵解相关酶, 不能进行糖酵解及脂肪酸氧化, 一旦出现缺血、缺氧则导致大量乳酸堆积进而引起神经元凋亡[11]。因此, AMPK在脊髓缺血再灌注损伤中的作用可能与肝脏、肾脏缺血再灌注损伤不同。有研究发现, AMPK介导的自噬在脑缺血再灌注损伤大鼠模型中发挥重要作用, 抑制AMPK活性可减少神经元凋亡[12]。
本研究结果显示, 模型组、生理盐水组大鼠脊髓组织中p-AMPK蛋白相对表达量均高于假手术组, AMPK蛋白相对表达量均低于假手术组; 而AMPK抑制剂组p-AMPK蛋白相对表达量与模型组和生理盐水组相比均降低, AMPK蛋白相对表达量均升高。说明大鼠发生脊髓缺血再灌注损伤后AMPK活性增强, Compound C可有效抑制AMPK活性。模型组、生理盐水组和AMPK抑制剂组6、12、24和48 h时BBB评分与假手术组相比均降低, AMPK抑制剂组6、12、24和48 h时BBB评分与模型组和生理盐水组相比均升高, 说明大鼠发生脊髓缺血再灌注损伤时出现神经功能障碍, 而进行Compound C干预后, 则可改善神经运动功能。上述结果提示AMPK参与大鼠脊髓缺血再灌注损伤, 而抑制AMPK活性有助于改善大鼠神经运动功能。HE染色结果显示, 假手术组脊髓组织结构清晰完整, 模型组和生理盐水组大鼠脊髓组织出现神经元变性和坏死、炎性细胞浸润, 而AMPK抑制剂组大鼠脊髓组织病理改变减轻、坏死减少; TUNEL法检测结果进一步显示, 脊髓缺血再灌注损伤后神经元凋亡增加, 而采用Compound C抑制AMPK活性后, 大鼠脊髓组织中神经元凋亡减少。说明AMPK参与大鼠脊髓缺血再灌注损伤的病理过程、促进神经元凋亡, 而抑制AMPK活性后可减轻脊髓缺血再灌注损伤程度、减少神经元凋亡, 从而发挥保护脊髓组织的作用。
转录因子NF-κB是调控炎性反应的关键因子, 通常情况下与其抑制因子IκBα结合而失活; 当受到外界刺激时, IκBα被磷酸化而与NF-κB解离, 活化的NF-κB在与其靶基因结合后可诱导IL-1β、IL-6和TNF-α等炎性细胞因子大量分泌[13]。本研究结果显示, 与假手术组相比, 模型组、生理盐水组大鼠脊髓组织中NF-κB和p-IκBα蛋白相对表达量均升高, 而IκBα蛋白相对表达量降低; 同时, IL-1β、IL-6和TNF-α浓度均升高。说明发生脊髓缺血再灌注损伤时, 脊髓组织中NF-κB通路活化介导的炎性反应参与了脊髓缺血再灌注损伤过程。抑制AMPK活性后, 大鼠脊髓组织中NF-κB和p-IκBα蛋白相对表达量均降低, 而IκBα蛋白相对表达量升高, IL-1β、IL-6和TNF-α浓度均降低, 说明抑制AMPK活性可能通过抑制NF-κB通路介导的炎性反应而参与脊髓保护。
综上所述, AMPK参与大鼠脊髓缺血再灌注损伤, 其机制可能与NF-κB通路介导的炎性反应有关; 抑制AMPK活性可减轻大鼠脊髓缺血再灌注损伤、保护神经元。上述结果表明, AMPK在大鼠脊髓缺血再灌注损伤中发挥重要作用, 为脊髓缺血再灌注损伤的防治提供了潜在靶点。
| [1] |
余奇劲, 解立杰, 胡霁. 脊髓缺血再灌注损伤与血脊髓屏障关系的研究进展[J]. 实用医学杂志, 2016, 32(12): 2066-2068. DOI:10.3969/j.issn.1006-5725.2016.12.053 |
| [2] |
Wyndaele JJ. Studies on protection against ischemia reperfusion injury after SCI[J]. Spinal Cord, 2016, 54(4): 247-251. DOI:10.1038/sc.2016.40 |
| [3] |
Wang L, Li S, Liu Y, et al. Motor neuron degeneration following glycine-mediated excitotoxicity induces spastic paralysis after spinal cord ischemia/reperfusion injury in rabbit[J]. Am J Transl Res, 2017, 9(7): 3411-3421. |
| [4] |
Day EA, Ford RJ, Steinberg GR. AMPK as a therapeutic target for treating metabolic diseases[J]. Trends Endocrinol Metab, 2017, 28(8): 545-560. DOI:10.1016/j.tem.2017.05.004 |
| [5] |
王振飞, 吴文坚, 陈新用, 等. SIRT2在大鼠脊髓缺血再灌注损伤中的作用[J]. 脊柱外科杂志, 2015, 13(2): 110-114. DOI:10.3969/j.issn.1672-2957.2015.02.012 |
| [6] |
Hu J, Yu Q, Xie L, et al. Targeting the blood-spinal cord barrier:a therapeutic approach to spinal cord protection against ischemia-reperfusion injury[J]. Life Sci, 2016, 158(8): 1-6. |
| [7] |
Troncone M, Cargnelli SM, Villani LA, et al. Targeting metabolism and AMP-activated kinase with metformin to sensitize non-small cell lung cancer(NSCLC) to cytotoxic therapy:translational biology and rationale for current clinical trials[J]. Oncotarget, 2017, 8(34): 57733-57754. |
| [8] |
Chun MJ, Choi H, Jun DW, et al. Fanconi anemia protein FANCD2 is activated by AICAR, a modulator of AMPK and cellular energy metabolism[J]. FEBS Open Bio, 2017, 7(2): 284-292. DOI:10.1002/2211-5463.12185 |
| [9] |
薛帅, 曾承, 方泽鸿, 等. AMPK减轻肝脏缺血再灌注损伤作用的研究进展[J]. 中华器官移植杂志, 2017, 38(5): 312-315. DOI:10.3760/cma.j.issn.0254-1785.2017.05.013 |
| [10] |
周俊, 林文静, 林森, 等. AMPK通过抑制炎性反应减轻小鼠肾脏缺血再灌注后纤维化[J]. 中华肾脏病杂志, 2016, 32(6): 450-456. DOI:10.3760/cma.j.issn.1001-7097.2016.06.009 |
| [11] |
Lin WP, Xiong GP, Lin Q, et al. Heme oxygenase-1 promotes neuron survival through down-regulation of neuronal NLRP1 expression after spinal cord injury[J]. J Neuroinflammation, 2016, 13(1): 52. DOI:10.1186/s12974-016-0521-y |
| [12] |
Shen P, Hou S, Zhu M, et al. Cortical spreading depression preconditioning mediates neuroprotection against ischemic stroke by inducing AMP-activated protein kinase-dependent autophagy in a rat cerebral ischemic/reperfusion injury model[J]. J Neurochem, 2017, 140(5): 799-813. DOI:10.1111/jnc.13922 |
| [13] |
Li S, Liu X, Lei J, et al. Crocin protects podocytes against oxidative stress and inflammation induced by high glucose through inhibition of NF-κB[J]. Cell Physiol Biochem, 2017, 42(4): 1481-1492. DOI:10.1159/000479212 |
 2019, Vol.17
2019, Vol.17  Issue(4): 267-272
Issue(4): 267-272


