痛风是嘌呤代谢障碍引起的代谢性疾病, 多数累及全身肢体末端关节, 也可侵犯脊柱, 引起椎间盘炎[1]。脊柱痛风多发生在腰椎, 其次是颈椎和胸椎[2]。发生在颈椎部位的痛风极为少见, 诊断困难, 痛风石沉积关节突关节及软骨终板后易引起骨质破坏, 容易误诊, 临床上应注意与感染及肿瘤相鉴别[3]。2018年5月, 本院收治颈椎椎间盘痛风石沉积患者1例, 后经病理证实为颈椎痛风性椎间盘炎, 现将诊疗过程报告如下。
1 病例资料患者, 男, 62岁, 因颈痛伴右上肢疼痛、麻木1年入院。既往有痛风病史10余年, 间断性口服别嘌醇、苯溴马隆及非甾体抗炎药物, 尿酸控制欠佳, 四肢关节及体表皮肤未见痛风石。入院查体:C4~7压痛、叩击痛阳性; 双上肢感觉未见明显异常, 右上肢肌力稍减弱, 肱桡肌、肱三头肌肌力4-级, 右上肢臂丛牵拉试验(+), 右侧椎间孔挤压试验(+), 叩顶试验(+), 右侧肱二头肌、肱三头肌反射活跃, 双侧Hoffman征(+)。实验室检查:C反应蛋白(CRP)28.6 mg/L、红细胞沉降率(ESR)48 mm/h、尿酸488 μmol/L、白细胞计数6.93×109/L、中性粒细胞计数4.27×109/L、中性粒细胞比例61.6%。影像学检查:颈椎椎间盘CT平扫示C4/C5/C6/C7椎间盘突出, C6水平后纵韧带骨化, C5~7椎体前缘可见“鸟嘴样”骨赘, 终板散在圆形虫蚀样骨质破坏(图 1a~c); 颈椎MRI示C6上缘局部骨质凹陷、信号增高, C4/C5/C6/C7椎间盘突出, 相应水平硬膜囊及颈髓前缘受压, C5~7水平双侧神经根受压(图 1d, e)。疼痛视觉模拟量表(VAS)评分颈部7分, 右上肢8分。肌电图提示上肢神经源性损伤电生理改变, 累及右侧臂丛中干及C7神经根为主。诊断为颈椎椎间盘突出症、颈椎后纵韧带骨化症及C5~7椎体终板骨质破坏。
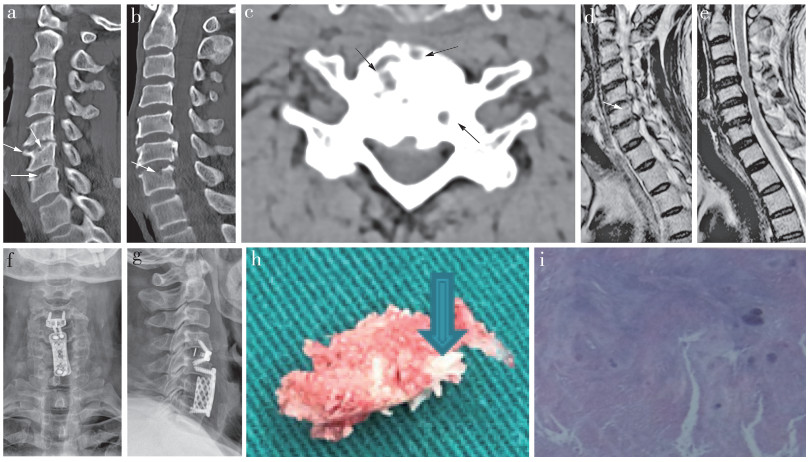
|
a ~ c:术前CT示C5~7椎体终板散在圆形“虫蚀样”骨质破坏d, e:术前MRI示C6椎体上缘局部骨质凹陷、T2信号增高, C4/C5/C6/C7椎间盘突出, 相应水平硬膜囊及颈髓前缘受压, C5~7水平双侧神经根受压f, g:术后正侧位X线片示内固定位置良好h:术中取出的组织中可见白色沙粒状组织(箭头) i:病理检查示无定形样炎性组织 图 1 病例影像学资料 |
患者入院后给予非甾体抗炎药物及颈椎牵引等治疗, 效果一般。于2018年5月行手术治疗, 全身麻醉下行颈前路C4/C5椎间盘切除、椎间零切迹植骨融合、C6椎体次全切除、C5/C6/C7节段钛网植骨融合术。术中切开纤维环, 用髓核钳将C5/C6/C7椎间盘及髓核摘除, 术后X线片示内固定位置良好(图 1f, g), 取出的组织中可见白色沙粒状组织(图 1h)。椎间盘及白色沙粒状组织病理检查结果示局部炎症细胞浸润、软组织周围点状钙化灶, 符合痛风病理改变(图 1i)。术后患者低嘌呤饮食, 给予抗炎、促尿酸排泄等治疗, 第2天戴颈托下床活动, 术后颈痛及右上肢疼痛明显缓解, 手术效果良好。患者出院后未回院复查, 电话随访, 症状缓解明显。
2 讨论本例患者无肿瘤及感染病史, 肿瘤标志物阴性, 排除脊柱肿瘤及感染后, 考虑尿酸盐沉积致使椎体终板骨质破坏, 术中探查见椎间盘内大量白色沙粒状组织, 术后病理切片提示符合痛风改变, 因此, 综合考虑可确诊。患者椎间隙内痛风石的形成可能参与了椎间盘退行性变和椎体终板骨质破坏的过程, 并最终导致了椎间盘突出和椎间不稳。因此, 当痛风患者有颈椎疾病症状和体征、影像学检查示椎体终板散在圆形骨质破坏、相应节段呈“鸟嘴样”骨赘等椎间不稳征象, 并结合尿酸增高及身体其他部位痛风石, 应高度怀疑为颈椎痛风性椎间盘炎。
脊柱痛风可发生于任何椎体、关节突关节或黄韧带组织, 其发生可能与脊柱的损伤和退行性变、继发尿酸盐结晶沉积有关。35%脊柱痛风患者的痛风病史 > 3年且服用药物不规律[4]。King等[5]认为尿酸盐结晶会对关节、骨质造成破坏, 加速椎间盘发生退行性变, 导致节段不稳。痛风病史及体表痛风体征可作为诊断标准之一。Jegapragasan等[6]认为, 对于有腰痛或下肢疼痛麻木的患者, 若既往确诊为痛风, 尤其伴有皮肤关节处痛风石, 诊断在考虑脊柱常见病的同时, 还应考虑痛风性脊柱炎的可能。
目前, 脊柱痛风的诊断金标准仍为组织病理学检查。实验室检查几乎均显示血尿酸异常升高。影像学检查包括X线、MRI及CT。X线片表现通常无特异性, MRI诊断脊柱痛风阳性率高, 但缺乏特异性。有文献报道, 脊柱痛风组织在T1加权像为低或等信号、T2加权像为低或等或高信号, 增强MRI为不均匀或均匀的增强信号[7]。本例患者MRI示C6椎体上缘局部骨质凹陷、T1加权像信号降低、T2加权像信号增高, 符合痛风性脊柱炎表现。CT表现为椎体、椎板或关节突“钻凿状”溶骨性骨质破坏[8], 本例患者颈椎CT示椎体终板散在“虫蚀样”圆形骨质破坏。综上, 脊柱痛风的影像学表现复杂, 缺乏特异性, 仅可作为诊断参考, 缺乏决定性意义。双能双源CT(DECT)是近年来出现的新的影像学检查技术, 可清晰显示尿酸盐结晶, 明确组织病理产物沉积部位, 为痛风的诊断提供了新途径, 在痛风早期筛查上具有重要价值[9], 有学者对比分析普通CT与DECT对关节痛风石沉积的诊断价值, 发现DECT阳性率明显高于普通CT[10], DECT识别痛风的灵敏度和特异度分别为91.9%和85.4%, 可作为痛风筛选的常规检查项目[11]。
目前脊柱痛风相关文献仅见于散在的个案报道中, 且单纯通过临床症状和体征、影像学及实验室检查难以确诊, 临床确诊通常依赖术中探查发现白色沙粒状组织及术后病理检查证实。Draganescu等[12]认为, 体内的高尿酸状态会加速尿酸盐的沉积, 无论手术与否, 患者都需服用降尿酸药物。邹云龙等[13]报道手术治疗1例L4/L5痛风性椎间盘炎并L4椎体滑脱坐骨神经受累的患者, 术后神经功能显著改善。Dhȏte等[15]强调脊柱痛风尤其应重视早期药物治疗, 长期规范的药物治疗可使脊柱痛风石逐渐消失。综上, 脊柱痛风应该早诊断早治疗, 无神经损伤症状者可采用非手术治疗, 给予非甾体抗炎药物、碱化尿液及降尿酸药物; 有神经损伤症状者则应考虑手术治疗[14]。
回顾既往报道, 大部分脊柱痛风患者采取手术治疗充分减压, 配合术后药物治疗, 效果理想。结合笔者的临床经验, 如患者有痛风病史, 入院后血尿酸异常升高, 且ESR、CRP高, CT检查发现椎体终板有骨蚀破坏, MRI信号异常者, 排除脊柱感染及肿瘤后, 应高度怀疑为痛风性脊柱炎; 如患者脊柱局部有明显破坏且有神经压迫症状, 可行病灶清除减压术, 多可获得满意的疗效; 术中尿酸盐结晶探查及术后病理检查有助于确诊。
| [1] |
Suk KS, Kim KT, Lee SH, et al. Tophaceous gout of the lumbar spine mimicking pyogenic discitis[J]. Spine J, 2007, 7(1): 94-99. |
| [2] |
Hou LC, Hsu AR, Veeravagu A, et al. Spinal gout in a renal transplant patient:a case report and literature review[J]. Surg Neurol, 2007, 67(1): 65-73. |
| [3] |
Yamamoto M, Tabeya T, Masaki Y, et al. Tophaceous gout in the cervical spine[J]. Intern Med, 2012, 51(3): 325-328. DOI:10.2169/internalmedicine.51.6262 |
| [4] |
Yen HL, Cheng CH, Lin JW. Cervical myelopathy due to gouty tophi in the intervertebral disc space[J]. Acta Neurochir(Wien), 2002, 144(2): 205-207. DOI:10.1007/s007010200026 |
| [5] |
King JC, Nicholas C. Gouty arthropathy of the lumbar spine:a case report and review of the literature[J]. Spine(Phila Pa 1976), 1997, 22(19): 2309-2312. DOI:10.1097/00007632-199710010-00023 |
| [6] |
Jegapragasan M, Calniquer A, Hwang WD, et al. A case of tophaceous gout in the lumbar spine:a review of the literature and treatment recommendations[J]. Evid Based Spine Care J, 2014, 5(1): 52-56. DOI:10.1055/s-0034-1366979 |
| [7] |
Thornton FJ, Torreggiani WC, Brennan P. Tophaceous gout of the lumbar spine in a renal transplant patient:a case report and literature review[J]. Eur J Radiol, 2000, 36(3): 123-125. |
| [8] |
See LC, Kuo CF, Chuang FH, et al. Hyperuricemia and metabolic syndrome:associations with chronic kidney disease[J]. Clin Rheumatol, 2011, 30(3): 323-330. |
| [9] |
李依寒, 邱明山, 陈进春. 腰椎间盘沉积痛风石1例[J]. 风湿病与关节炎, 2015, 4(12): 46-48. |
| [10] |
Dalbeth N, Aati O, Kalluru R, et al. Relationship between structural joint damage and urate deposition in gout:a plain radiography and dual-energy CT study[J]. Ann Rheum Dis, 2015, 74(6): 1030-1036. DOI:10.1136/annrheumdis-2013-204273 |
| [11] |
Bongartz T, Glazebrook KN, Kavros SJ, et al. Dualenergy CT for the diagnosis of gout:an accuracy and diagnostic yield study[J]. Ann Rheum Dis, 2015, 74(6): 1072-1077. DOI:10.1136/annrheumdis-2013-205095 |
| [12] |
Draganescu M, Leventhal LJ. Spinal gout:case report and review of the literature[J]. J Clin Rheumatol, 2004, 10(2): 74-79. |
| [13] |
邹云龙, 李野, 王永琨, 等. 痛风性椎间盘炎合并腰椎椎体后滑脱1例[J]. 中国脊柱脊髓杂志, 2016, 26(9): 858-861. DOI:10.3969/j.issn.1004-406X.2016.09.15 |
| [14] |
张锐, 彭文琦, 赵汉平, 等. 脊柱痛风致脊神经损伤1例报告[J]. 中国矫形外科杂志, 2017, 25(13): 1243-1245. |
| [15] |
Dhôte R, Roux FX, Bachmeyer C, et al. Extradural spinal tophaceous gout:evolution with medical treatment[J]. Clin Exp Rheumatol, 1997, 15(4): 421-423. |
 2019, Vol.17
2019, Vol.17  Issue(4): 294-296
Issue(4): 294-296


