骨质疏松症是一种以骨强度下降和骨折风险增加为特征的骨骼疾病[1]。随着人口的老龄化,2015年中国骨质疏松症总患病人数为6 000~8 000万,其中每年约有700 000例与骨质疏松相关的椎体骨折发生[2]。骨质疏松性椎体压缩性骨折(OVCF)可引起腰背部疼痛、活动受限,机体功能下降,甚至导致胃肠道等内脏功能紊乱,严重影响老年人生活质量[3]。由于应力集中,骨折多发生于胸腰椎,本研究组既往报道显示,胸腰椎骨折占OVCF总数的比例 > 81%[4]。自从采用聚甲基丙烯酸甲酯(PMMA)骨水泥的经皮椎体成形术(PVP)被Galibert等[5]应用于治疗椎体血管瘤以来,因其创伤小、安全性高、缓解疼痛效果好、术后恢复快,已逐渐成为治疗OVCF最常用的微创方法之一[6]。PVP采用特定的医疗器材穿刺皮肤,经过/不经过椎弓根向伤椎椎体注入填充材料,使伤椎的稳定性和强度增强[7]。但关于骨水泥合理注入量的相关研究仍不充分,至今仍无统一标准。骨水泥注入过少,术后可能出现疼痛改善不明显、椎体高度进一步丢失,造成严重后凸畸形和持续性腰痛,甚至骨折端移位压迫神经;注入过多,可能导致骨水泥渗漏等手术相关并发症。了解骨水泥剂量与疗效、并发症的关系,明确合理注入量,对提高疗效具有重要意义。本研究回顾性分析2017年3月—2018年12月接受PVP治疗的胸腰椎单椎体OVCF患者的中短期疗效和并发症发生情况,为PVP术中骨水泥的合理注入量提供参考,现报告如下。
1 资料与方法 1.1 一般资料收集采用Vertecem V+高黏度骨水泥(强生,美国)行PVP治疗的明确诊断为胸腰椎(T12 ~ L2)单椎体新鲜OVCF患者的临床资料,共纳入临床及影像学资料完整患者95例进行回顾性分析。根据术中实际注入骨水泥剂量分为3组:A组(< 3.5 mL)45例,B组(≥3.5 mL且≤6.0 mL)23例,C组(> 6.0 mL且≤8.5 mL)27例。所有手术均由PVP操作熟练的同一脊柱外科副主任医师完成。3组患者一般资料组间比较,差异均无统计学意义(P > 0.05,表 1),具有可比性。本研究获本院伦理委员会批准(审批号:SH9H-2019-T90-1),所有患者及家属知情同意且签署知情同意书。
|
|
表 1 3组患者一般资料 Tab. 1 General data of 3 groups |
所有患者均采用双侧椎弓根入路。患者取俯卧位,胸腰段保持过伸体位,给予骨折椎体一定程度体位复位。用C形臂X线机透视定位责任节段和穿刺点,1%利多卡因局部麻醉后置入穿刺套管针,在间断透视下缓慢沿椎弓根通道进入椎体,针尖达椎体前中1/3交界处时停止进针,静脉注射甲泼尼龙80 mg预防过敏反应。调配骨水泥,取出针芯,连接装有骨水泥的注射器,缓慢匀速推注骨水泥,每次双侧共推注约0.5 mL。每次推注后均在透视下观察骨水泥弥散情况,并及时调整穿刺针深度及方向,尽量避免发生渗漏;同时与患者即时沟通,若出现神经症状,立即停止推注。按上述方法,尽量使骨水泥于椎体内均匀分布填充,直至目标剂量(术中间断透视显示骨水泥向上下终板渗透,达到“顶天立地”效果,或继续注射骨水泥不再向上下方向渗透,视为达到目标剂量)。待骨水泥凝固后拔出穿刺针。术后患者平卧休息,监测生命体征及双下肢运动、感觉情况。术后2 d行X线检查,观察椎体高度恢复及椎体内骨水泥充盈、渗漏状况。术后2 d ~ 3周,患者可佩戴腰围适当下床活动,但仍以平卧休息为主。同时给予每日1次维生素D3 +碳酸钙口服联合鲑鱼降钙素鼻喷剂20 IU外用进行抗骨质疏松治疗。
1.3 观察指标记录所有患者骨水泥注入量及渗漏情况、伤椎Cobb角、椎体前缘高度比及并发症发生情况。Cobb角为伤椎相邻上位椎体上终板延长线与相邻下位椎体下终板延长线间的夹角。椎体前缘高度比(%)= 2×伤椎前缘高度/(伤椎上位椎体前缘高度+伤椎下位椎体前缘高度)×100%。采用疼痛视觉模拟量表(VAS)评分[8]评估腰背部疼痛缓解情况。根据患者术后影像学资料判断骨水泥渗漏情况(软组织渗漏、血管内渗漏、椎间盘渗漏、经穿刺通道渗漏、椎管内渗漏、混合渗漏)。
1.4 统计学处理采用SPSS 19.0软件对数据进行统计学分析,计量资料以x±s表示,3组的方差齐性数据组间比较采用单因素方差分析,组间两两比较采用独立样本t检验,组内比较采用配对t检验,计数资料以百分比表示,采用χ2检验;以P < 0.05为差异有统计学意义。
2 结果3组患者术后1 h、术后2 d和末次随访时VAS评分与术前相比均显著降低,差异有统计学意义(P < 0.05,表 2);术后2 d和末次随访时VAS评分A组 > B组 > C组,组间两两比较,差异均有统计学意义(P < 0.05,表 2);术后1 h VAS评分A组 < B组 < C组,组间两两比较,差异均有统计学意义(P < 0.05,表 2)。3组患者术后2 d较术前伤椎Cobb角均减小,椎体前缘高度比均增大,但组间两两比较,差异无统计学意义(P > 0.05,表 2);3组末次随访时较术后2 d伤椎Cobb角均增大,椎体前缘高度比均减小,且组间两两比较,差异有统计学意义(P < 0.05,表 2)。3组患者共38例发生骨水泥渗漏,渗漏类型见表 2。骨水泥渗漏率为44.7%,其中A组16例(35.6%),B组9例(39.1%),C组13例(48.1%),组间两两比较,差异无统计学意义(P > 0.05,表 2)。3组均未发生继发性骨水泥渗漏或其他严重并发症。典型病例影像学资料见图 1。
|
|
表 2 3组患者统计数据 Tab. 2 Statistical data of 3 groups |
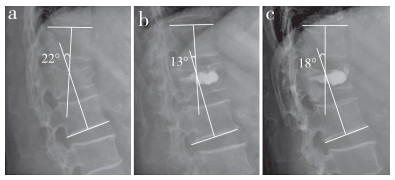
|
男,71岁,L1 OVCF,骨水泥注入量为3.4 mL a:术前椎体前缘高度比59%,伤椎Cobb角22° b:术后2 d椎体前缘高度比75%,伤椎Cobb角13° c:末次随访椎体前缘高度比67%,伤椎Cobb角18° Male, 71 years old, L1 OVCF, amount of bone cement injection is 3.4 mL a:Preoperative ratio of vertebra anterior edge height is 59%, Cobb's angle of injured vertebra is 22° b:Ratio of vertebra anterior edge height at postoperative 2 d is 75%, Cobb's angle of injured vertebra is 13° c:Ratio of vertebra anterior edge height at final follow-up is 67%, Cobb's angle of injured vertebra is 18° 图 1 典型病例影像学资料 Fig. 1 Imaging data of a typical case |
随着社会老龄化的加剧,骨质疏松症患者不断增多。由于骨量丢失和微结构破坏,骨质疏松症患者在轻微外力甚至体质量的重力作用下即可出现椎体变形、破坏,引起OVCF[9],严重影响老年人生活质量,增加死亡率。传统的治疗措施包括应用抗骨质疏松药物(钙剂、维生素D、鲑鱼降钙素、二磷酸盐等)、镇痛、卧床休息、佩戴支具等[10]。然而,据Goldstein等[11]报道,超过40%的OVCF患者经非手术治疗12个月后疼痛无法获得满意缓解。而传统的开放性手术创伤大、出血量大,且难以获得牢靠固定,对于OVCF并不是一个理想的治疗手段[12],仅适合应用于伴有神经脊髓压迫或脊柱结构严重失衡的患者。PVP作为新型微创手术,创伤小、恢复快,疗效确切,目前已广泛应用于疼痛性OVCF的治疗。PVP通过将骨水泥弥散至骨折断端和断裂的骨小梁,使椎体重新成为坚固整体,重建椎体生物力学性能,同时可避免骨折端微动引起的疼痛。有研究显示,椎体强度的恢复可以防止椎体在外力下进一步压缩,而刚度的恢复可以使椎体更加稳定,防止骨小梁微动,减少疼痛,并为骨折愈合提供稳定环境[13]。但是,关于骨水泥理想注射剂量仍无统一标准。骨水泥注入量过小,不能有效固定断裂的骨小梁,难以有效恢复伤椎生物力学性能,出现术后慢性疼痛,椎体逐渐塌陷,甚至再次骨折;骨水泥注入量过大,有渗漏率增高风险。
本研究结果显示,在疼痛改善方面,3组患者术后2 d和末次随访时VAS评分较术前均不同程度改善,并随着骨水泥注入量的增加,止痛效果也相应更加明显。末次随访时A组部分患者疼痛仍较明显,甚至较术后2 d加重,辅以药物和卧床制动后疼痛多在数周至数月内好转,但B、C组则较少出现上述情况,尤其是C组大部分患者在末次随访时疼痛缓解良好。由此可见,一定范围内骨水泥注入量的增加可提高PVP术后疼痛缓解的中短期疗效。但3组患者术后1 h的VAS评分A组最优,B组次之,C组最差,可见骨水泥注入量的增加可加重患者术后极短期的腰背痛程度,大剂量组(C组)患者尤为明显,甚至部分患者术中、术后出现血压升高、心率增快。虽然PVP为微创手术,但是鉴于手术患者绝大部分年龄较大,围手术期心血管指标应引起足够重视。
影像学指标方面,3组术后2 d伤椎Cobb角较术前均减小,椎体前缘高度均增大,结合术中C形臂X线机连续透视对比结果和既往研究[14],笔者认为,术后影像学指标改善主要归因于术前和术中的体位复位,骨水泥只是分散到骨折微小裂隙中,维持复位高度,而术中注入骨水泥过程中几乎没有观察到伤椎Cobb角和椎体前缘高度的明显改善,故单纯骨水泥注入量的增加并不能显著改善术后短期的影像学指标。但是,3组患者末次随访较术后2 d伤椎Cobb角均增大,椎体前缘高度均减小。因此,骨水泥注入量的增加有利于更好地恢复脊柱机械平衡,预防椎体前缘进一步塌陷引起胸腰段后凸畸形,从而避免椎体前方应力集中,导致手术椎体和相邻椎体再骨折[15-16],有效提高中长期疗效。
骨水泥渗漏方面,3组发生率两两比较组间差异无统计学意义,同时由于纳入病例数较少,各细分类型也未能体现统计学差异。然而,实际阅片过程中发现,A组渗漏量较少,部分甚至X线片不能明确辨别,仅CT可见,而C组渗漏量通常较A组多,且多数X线片清晰可辨。但是,相关数据不充足,具体骨水泥渗漏发生率和渗漏量与注入量的关系还有待进一步研究。目前,PVP术中骨水泥注入量相关临床和生物力学研究较多,但观点不尽相同。疗效方面,Barr等[17]认为,胸腰段注入3 ~ 5 mL骨水泥即可获得较好的椎体稳定性和疼痛改善。Papanastassious等[18]认为,合理的骨水泥注入量为胸椎平均5.5 mL,腰椎平均7.0 mL。Nieuwenhuijse等[19]建议,骨水泥理想注入量应为椎体体积的24%。Zhu等[20]的研究显示,为避免渗漏,骨水泥注入量,胸椎 < 3.5 mL,腰椎 < 4.0 mL。本研究发现,PVP术中小剂量组(A组)患者可获得一定程度的疼痛缓解和短期影像学指标的改善,但效果明显不及中、大剂量组(B、C组),尤其在末次随访时发现A组部分患者症状反复,影像学指标明显不及术后短期。在骨水泥渗漏率方面,3组未体现出统计学差异,亦未见大剂量组(C组)出现严重并发症。既往研究发现,骨水泥渗漏率和注入量呈正相关,同时,也受到患者性别、年龄、伤椎节段、骨密度、骨折类型、骨水泥类型、骨水泥在椎体内分布、穿刺通道数量等多种因素的影响[19-24],因此,避免并发症的发生应综合考虑上述因素。
综上所述,胸腰段骨质疏松性骨折患者,在一定范围内,注入更大剂量骨水泥可获得更优的中短期腰背痛缓解和影像学指标改善,疗效确切。但注入更大剂量骨水泥术后极短期内腰背痛也更加明显,此外,对可能存在的骨水泥渗漏风险增高和渗漏量增多的风险也应重视。对此,临床中应全面衡量各种相关因素,制订个体化治疗方案,尽量在降低并发症发生率的同时提高疗效,使患者最大获益。但本研究样本量小,随访资料不充分,结论仍有待更大样本量和更全面的临床研究进一步验证,以期获得更加准确的结果。
| [1] |
No author listed. NIH consensus development panel on osteoporosis prevention, diagnosis, and therapy, March 7-29, 2000:highlights of the conference[J]. South Med J, 2001, 94(6): 569-573. |
| [2] |
印平, 马远征, 马迅, 等. 骨质疏松性椎体压缩性骨折的治疗指南[J]. 中国骨质疏松杂志, 2015, 21(6): 643-648. DOI:10.3969/j.issn.1006-7108.2015.06.001 |
| [3] |
Sebaaly A, Nabhane L, Issa El Khoury F, et al. Vertebral augmentation:state of the art[J]. Asian Spine J, 2016, 10(2): 370-376. DOI:10.4184/asj.2016.10.2.370 |
| [4] |
王惠东, 姚方超, 傅智轶, 等. 大剂量骨水泥经皮椎体成形术治疗老年胸腰椎骨折的疗效及其影响因素[J]. 创伤外科杂志, 2019, 21(5): 340-345. DOI:10.3969/j.issn.1009-4237.2019.05.005 |
| [5] |
Galibert P, Deramond H, Rosat P, et al. Preliminary note on the treatment of vertebral angioma by percutaneous acrylic vertebroplasty[J]. Neurochirurgie, 1987, 33(2): 166-168. |
| [6] |
Muto M, Marcia S, Guarnieri G, et al. Assisted techniques for vertebral cementoplasty:why should we do it?[J]. Eur J Radiol, 2015, 84(5): 783-788. DOI:10.1016/j.ejrad.2014.04.002 |
| [7] |
Yi X, Lu H, Tian F, et al. Recompression in new levels after percutaneous vertebroplasty and kyphoplasty compared with conservative treatment[J]. Arch Orthop Trauma Surg, 2014, 134(1): 21-30. DOI:10.1007/s00402-013-1886-3 |
| [8] |
Huskisson EC. Measurement of pain[J]. Lancet, 1974, 2(7889): 1127-1131. |
| [9] |
Office of the Surgeon General(US). Bone health and osteoporosis: a report of the Surgeon General[R]. Rockville(MD): office of the Surgeon General(US), 2004.
|
| [10] |
Eck JC, Nachtigall D, Humphreys SC, et al. Comparison of vertebroplasty and balloon kyphoplasty for treatment of vertebral compression fractures:a meta-analysis of the literature[J]. Spine J, 2008, 8(3): 488-497. DOI:10.1016/j.spinee.2007.04.004 |
| [11] |
Goldstein CL, Chutkan NB, Choma TJ, et al. Management of the elderly with vertebral compression fractures[J]. Neurosurgery, 2015, 77(Suppl 4): S33-S45. |
| [12] |
Phillips FM, Pfeifer BA, Lieberman IH, et al. Minimally invasive treatments of osteoporotic vertebral compression fractures:vertebroplasty and kyphoplasty[J]. Instr Course Lect, 2003, 52: 559-567. |
| [13] |
宋戈, 吴春根, 程永德, 等. 经皮椎体成形术骨水泥注射量相关生物力学研究现状和进展[J]. 介入放射学杂志, 2018, 27(1): 87-90. |
| [14] |
Kulkarni AG, Shah SP, Deopujari CE. Epidural and intradural cement leakage following percutaneous vertebroplasty:a case report[J]. J Orthop Surg(Hong Kong), 2013, 21(3): 365-368. DOI:10.1177/230949901302100320 |
| [15] |
Guarnieri G, Tecame M, Izzo R, et al. Vertebroplasty using calcium triglyceride bone cement(KryptoniteTM)for vertebral compression fractures. A single-centre preliminary study of outcomes at one-year follow-up[J]. Interv Neuroradiol, 2014, 20(5): 576-582. |
| [16] |
张新亮, 孔令擘, 高文杰, 等. 骨水泥钉道强化植骨融合内固定治疗陈旧性骨质疏松压缩性骨折合并脊柱不稳的疗效分析[J]. 中国医师进修杂志, 2016, 39(9): 787-791. |
| [17] |
Barr JD, Barr MS, Lemley TJ, et al. Percutaneous vertebroplasty for pain relief and spinal stabilization[J]. Spine(Phila Pa 1976), 2000, 25(8): 923-928. DOI:10.1097/00007632-200004150-00005 |
| [18] |
Papanastassiou ID, Filis A, Gerochristou MA, et al. Controversial issues in kyphoplasty and vertebroplasty in osteoporotic vertebral fractures[J]. Biomed Res Int, 2014, 2014: 934206. |
| [19] |
Nieuwenhuijse MJ, Van Erkel AR, Dijkstra PD. Cement leakage in percutaneous vertebroplasty for osteoporotic vertebral compression fractures:identification of risk factors[J]. Spine J, 2011, 11(9): 839-848. DOI:10.1016/j.spinee.2011.07.027 |
| [20] |
Zhu SY, Zhong ZM, Wu Q, et al. Risk factors for bone cement leakage in percutaneous vertebroplasty:a retrospective study of four hundred and eighty five patients[J]. Int Orthop, 2016, 40(6): 1205-1210. DOI:10.1007/s00264-015-3102-2 |
| [21] |
江晓兵, 莫凌, 梁德, 等. 骨水泥在椎体骨折线内弥散情况对椎体成形术治疗效果的影响[J]. 中国脊柱脊髓杂志, 2014, 24(2): 144-149. DOI:10.3969/j.issn.1004-406X.2014.02.09 |
| [22] |
Liang D, Ye LQ, Jiang XB, et al. Biomechanical effects of cement distribution in the fractured area on osteoporotic vertebral compression fractures:a three-dimensional finite element analysis[J]. J Surg Res, 2015, 195(1): 246-256. DOI:10.1016/j.jss.2014.12.053 |
| [23] |
Zhong BY, He SC, Zhu HD, et al. Nomogram for predicting intradiscal cement leakage following percutaneous vertebroplasty in patients with osteoporotic related vertebral compression fractures[J]. Pain Physician, 2017, 20(4): E513-E520. |
| [24] |
Tomé-Bermejo F, Piñera AR, Duran-Álvarez C, et al. Identification of risk factors for the occurrence of cement leakage during percutaneous vertebroplasty for painful osteoporotic or malignant vertebral fracture[J]. Spine(Phila Pa 1976), 2014, 39(11): E693-E700. DOI:10.1097/BRS.0000000000000294 |
 2020, Vol.18
2020, Vol.18  Issue(4): 217-221, 236
Issue(4): 217-221, 236


