前路颈椎椎间盘切除融合术(ACDF)治疗颈椎病效果显著,尤其对于老年患者,在减轻脊髓压迫的同时还能有效改善颈部活动功能[1]。但融合术对椎体稳定性的维持受术后骨性结构重建的影响较大,老年患者多伴有不同程度的骨质疏松,对手术部位骨性结构的重建会产生不利影响,降低术后疗效[2]。唑来膦酸能有效抑制骨质疏松所致骨吸收及转换、增加骨密度及强度,具有较好的改善骨量丢失的作用[3]。Nakamura等[4]的研究显示,相较于口服二膦酸盐类药物,每年定期静脉输注唑来膦酸能有效改善骨质疏松症状,治疗方便,患者依从性较好。本研究旨在研究骨质疏松症患者行ACDF治疗术后早期静脉注射唑来膦酸对手术疗效及远期预后的影响,为合并骨质疏松症患者ACDF术后治疗方案选择提供参考。
1 资料与方法 1.1 一般资料纳入标准:①符合《原发性骨质疏松症诊疗指南(2017)》中原发性骨质疏松症诊断标准[5];②符合《颈椎病的分型、诊断及非手术治疗专家共识(2018)》中神经根型或脊髓型颈椎病的诊断标准,且符合ACDF手术适应证[6-7];③累及不超过2个颈椎节段;④患者意识清楚,治疗依从性较好,能定期接受随访。排除标准:①6个月内影响骨密度的药物服用史;②治疗药物不耐受;③1年内手术部位有外伤或骨折;④严重的全身性慢性疾病。根据上述标准,纳入2016年6月—2018年6月接受ACDF治疗的骨质疏松患者116例,按照随机数字表法分为2组,治疗组59例,对照组57例,2组患者术前一般资料差异无统计学意义(P > 0.05,表 1),具有可比性。所有患者知情同意并签署知情同意书。
|
|
表 1 2组患者一般资料 |
2组患者均采用ACDF治疗,全身麻醉后取仰卧位,保持颈部后伸状态,选择颈右斜侧或横切口进入,充分暴露术野。将螺钉置入预计减压部位并撑开椎间隙,取出椎间盘,并使用骨钳咬除椎体前后侧突出骨赘。随后探查椎体后缘,检查是否还存在突出结构,并将肥厚的后纵韧带切除,术中应注意探查硬膜囊受压情况,切除操作时以硬膜囊无明显压迫为度。使用刮匙清除病灶上下椎体的软骨终板,过程中需注意保持骨性终板完整性,将之前准备好的自体碎骨植入椎间隙。检查置入物稳定性并确定硬膜囊无受压,选择合适长度的钛板使用皮质螺钉固定于椎体前侧,并使用锁定螺钉锁紧。检查手术部位正常后关闭切口,术后常规抗感染处理,并使用颈托制动8周。
采用双盲对照研究方式,术后第5天治疗组予以唑来膦酸钠注射液(正大天晴药业集团股份有限公司,批号H20113138,规格100 mL:5 mg)5 mg静脉输注,对照组予以等量生理盐水静脉输注。2组患者术后5 d起均予以抗骨质疏松治疗:碳酸钙D3片(600 mg,每日2次)+骨化三醇胶囊(1粒,每日1次),用药至随访结束。
1.3 观察指标所有患者分别于术后3、6、12个月定期随访。随访时使用迈瑞CL-1200i全自动化学发光免疫分析仪采用ELISA法检测所有患者空腹静脉血中骨质疏松标志物,包括Ⅰ型胶原交联羧基末端肽(CTX)及骨形成Ⅰ型胶原蛋白(PINP)。采用双能X线吸收法测定患者双侧股骨颈及腰椎骨密度。采用颈部功能障碍指数(NDI)[8]评估临床疗效。统计2组患者随访期间二次手术率及相邻椎体压缩性骨折[5]发生率。记录2组患者内固定松动、人工骨脱出及融合器沉降等并发症发生情况。
通过颈椎X线检查评估椎间融合情况[9]。1级:完全融合(椎体间连续骨小梁生长,并具有显著的骨痂等骨重塑的证据。人工骨边缘无透明带,人工骨或周围椎体无骨折、塌陷或脱位,相邻终板内无囊性改变及线状缺损)。2级:显著融合(骨小梁连接椎体程度 > 75%,排除任何明显的骨不连迹象)。3级:不完全融合(人工骨及终板连接处部分骨桥形成或椎间隙骨痂形成)。4级:骨不连(人工骨及终板连接处有完整/连续的裂隙,且裂隙处边缘出现硬化或真空等现象;椎间骨桥不足;人工骨周围或内部没有连续的骨桥,边缘透明;人工骨或椎体可见骨折;相邻终板内囊性变化;椎骨的线性缺损或人工骨骨折线内部及周围有新骨形成)。1、2级为融合良好,3、4级为融合不良。
1.4 统计学处理采用SPSS 22.0软件对数据进行统计学分析。符合正态分布的计量资料以x±s表示,组间比较采用独立样本t检验,不服从正态分布的数据采用U检验,重复资料采用重复测量方差分析;计数资料以相对数表示,组间比较采用χ2检验,等级资料比较采用H检验,理论频数 < 1时采用Fisher确切概率检验;二次手术及相邻椎体压缩性骨折发生情况比较采用Kaplan-Meier分析;以P <0.05为差异有统计学意义。
2 结果所有手术顺利完成。术后3、6、12个月时,治疗组骨质疏松标志物CTX、PNIP低于术前;对照组CTX高于术前,PNIP低于术前;术后各时间点组间比较差异显著;以上数据间比较差异均有统计学意义(P <0.05,表 2)。治疗组术后6、12个月及对照组术后12个月骨密度均较术前改善,且治疗组术后6、12个月较对照组相比改善更为明显,差异均有统计学意义(P <0.05,表 2)。2组术后3、6、12个月NDI较术前明显改善,治疗组术后6、12个月时NDI较对照组改善更为明显,差异均有统计学意义(P <0.05,表 2)。治疗组术后6、12个月椎间1级融合率高于对照组,差异有统计学意义(P <0.05,表 2)。
|
|
表 2 2组患者术后统计数据 |
治疗组术后发生融合器沉降1例,并发症发生率为1.69%(1/59);对照组术后发生融合器沉降5例,内固定松动2例,并发症发生率为12.28%(7/57);组间比较差异有统计学意义(P <0.05)。
治疗组随访期间二次手术率及相邻椎体压缩性骨折发生率分别为1.69%(1/59)、0,对照组分别为8.77%(5/57)、12.28%(7/57),组间二次手术率差异无统计学意义(P > 0.05),相邻椎体压缩性骨折发生率差异有统计学意义(P < 0.05)。典型病例影像学资料见图 1。
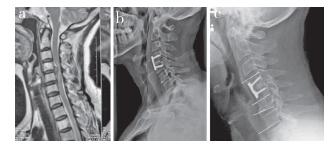
|
男,57岁 a:术前MRI示C4/C5椎间盘突出并压迫神经 b:术后3 d侧位X线片示内固定位置良好,邻近椎体位置正常 c:术后12个月侧位X线片示内固定物位置改变,钉道周围低密度影,螺钉松动,C4,5及相邻C6椎体发生形变,压缩明显 图 1 对照组术后相邻椎体发生压缩性骨折病例影像学资料 |
骨质疏松症是以骨量减少引起微结构损伤导致的全身性疾病,通常患者骨骼承受力显著下降,诱发骨折的危险系数显著增加[10]。ACDF对颈椎减压的同时,可防止结构不稳诱发的骨质增生等问题导致的硬膜囊受压,降低术后复发风险[11]。虽然术中采用钛板固定,但临床研究显示,椎体融合主要依赖融合椎体间的骨性结构联合;既往研究虽提示对于腰椎手术的骨质疏松患者进行早期抗骨质疏松治疗能有效改善预后,但目前对于抗骨质疏松治疗与椎体融合之间的关系尚无定论[12-13]。本研究组采用目前临床上最常用的药物唑来膦酸对骨质疏松患者ACDF术后进行早期抗骨质疏松治疗,取得了较好的疗效。
本研究结果显示,治疗组术后6、12个月时椎间融合效果显著优于对照组,提示抗骨质疏松治疗能有效提高融合率。虽然以往的动物实验显示,二膦酸盐类药物可以提升融合结构内的骨密度,但其对血管增殖的抑制作用也相对明显,可能导致骨融合生长速度减慢,故对其在骨质疏松患者术后的骨融合作用尚存争议[14-15]。笔者认为,抗骨质疏松治疗对骨融合的影响不仅局限于骨密度的改善及对血管增殖的抑制,Jie等[16]的研究结果提示,抗骨质疏松治疗可有效缓解腰椎融合术后因骨质疏松引起的疼痛等不良反应,促进患者早期康复训练,对骨融合有显著的促进作用。周绍波等[17]的研究提示,骨密度的提升还能有效防止内固定松动等不良反应,对腰椎融合患者远期疗效改善明显。
笔者对比国内外ACDF术后疗效相关研究时还发现,既往术中置入人工骨与椎体终板之间的接触面积较小、接触结构异常,对骨融合的成功率有显著影响;Ding等[18]的研究显示,术后融合率仅为56%,可能与此有关。术中通过刮匙将表面可能影响骨融合的软骨清除,同时选择模型时注意接触面积,可能是本研究骨融合率有所提升的原因之一。
NDI是评价颈椎活动功能的重要指标,本研究中治疗组术后NDI优于对照组,与以往研究显示的抗骨质疏松治疗能有效提升患者颈椎活动度的结果一致[19]。同时,本研究结果显示,治疗组术后CTX显著低于对照组,而PINP显著高于对照组。CTX是体内骨代谢的标志物,其含量与骨吸收呈正相关,治疗组术后CTX显著低于对照组,证实通过抗骨质疏松治疗能有效改善患者骨吸收情况,这与Kwak等[20]的研究结果一致。而PINP是骨、关节及周围组织形成的重要影响因素,其与骨形成有显著相关性[21]。2组术后均出现PNIP下降与手术导致的骨量丢失相关,而治疗组PINP显著高于对照组,证实采用抗骨质疏松治疗可减少由于骨质疏松导致的骨量丢失,改善患者症状。患者术后骨密度检查结果也提示,治疗组3个部位骨密度较对照组高。
治疗组并发症发生率较对照组低,与椎间融合好可有效防止融合器下沉有关,同时骨量增加能有效维持螺钉稳定性,故未出现内固定松动的情况。而上述并发症是导致患者二次手术的主要原因。本研究结果显示,2组患者二次手术率无显著差异,可能与样本量较小有关,将来需大样本量研究加以证实。骨质疏松患者ACDF术后上下相邻椎体骨量丢失加重,常规活动即会诱发相邻椎体压缩性骨折,本研究结果显示,对照组术后相邻椎体压缩性骨折发生率显著高于治疗组,治疗组中并无相邻椎体压缩性骨折发生,证实术后早期抗骨质疏松治疗能有效改善骨量丢失情况,防止术后相邻椎体压缩性骨折的发生,进一步改善患者预后。
综上所述,骨质疏松患者ACDF术后早期应用唑来膦酸抗骨质疏松治疗能有效改善椎体融合情况,降低手术导致的骨量丢失对病情的影响,改善患者预后。
| [1] |
杨兴, 薛峰, 盛晓文, 等. 人工颈椎椎间盘置换与颈前路减压融合术治疗脊髓型颈椎病的疗效分析[J]. 脊柱外科杂志, 2012, 10(6): 344-347. |
| [2] |
Wang M, Meng X, Li Y, et al. Effects of anti-osteoporosis treatment in the elderly with anterior cervical discectomy and fusion[J]. Acta Orthop Traumatol Turc, 2016, 50(2): 186-190. |
| [3] |
玄文虎, 欧阳剑锋, 王素伟, 等. 小剂量骨水泥椎体后凸成形联合唑来膦酸治疗骨质疏松椎体压缩性骨折[J]. 中国组织工程研究, 2017, 21(26): 4101-4105. |
| [4] |
Nakamura T, Fukunaga M, Nakano T, et al. Efficacy and safety of once-yearly zoledronic acid in Japanese patients with primary osteoporosis:two-year results from a randomized placebo-controlled double-blind study (ZOledroNate treatment in Efficacy to osteoporosis; ZONE study)[J]. Osteoporos Int, 2017, 28(1): 389-398. |
| [5] |
中华医学会骨质疏松和骨矿盐疾病分会. 原发性骨质疏松症诊疗指南(2017)[J]. 中华骨质疏松和骨矿盐疾病杂志, 2017, 10(5): 413-444. |
| [6] |
杨子明, 李放, 陈华江. 颈椎病的分型、诊断及非手术治疗专家共识(2018)[J]. 中华外科杂志, 2018, 56(6): 401-402. |
| [7] |
杨子明, 王少波, 刘宝戈, 等. 颈椎病的手术治疗及围手术期管理专家共识(2018)[J]. 中华外科杂志, 2018, 56(12): 881-884. |
| [8] |
Vernon H, Mior S. The neck disability index:a study of reliability and validity[J]. J Manipulative Physiol Ther, 1991, 14(7): 409-415. |
| [9] |
Siepe CJ, Stosch-Wiechert K, Heider F, et al. Anterior stand-alone fusion revisited:a prospective clinical, X-ray and CT investigation[J]. Eur Spine J, 2015, 24(4): 838-851. DOI:10.1007/s00586-014-3642-y |
| [10] |
Cauley JA. Osteoporosis:fracture epidemiology update 2016[J]. Curr opin Rheumatol, 2017, 29(2): 150-156. DOI:10.1097/BOR.0000000000000365 |
| [11] |
李宁, 申明奎, 白玉, 等. 颈椎前路椎间盘切除融合术和后路单开门椎板成形术治疗多节段脊髓型颈椎病的早期并发症对比[J]. 脊柱外科杂志, 2018, 16(5): 262-265. |
| [12] |
Chen F, Dai Z, Kang Y, et al. Effects of zoledronic acid on bone fusion in osteoporotic patients after lumbar fusion[J]. Osteoporos Int, 2016, 27(4): 1469-1476. DOI:10.1007/s00198-015-3398-1 |
| [13] |
Zwolak P, Farei-Campagna J, Jentzsch T, et al. Local effect of zoledronic acid on new bone formation in posterolateral spinal fusion with demineralized bone matrix in a murine model[J]. Arch Orthop Trauma Surg, 2018, 138(1): 13-18. DOI:10.1007/s00402-017-2818-4 |
| [14] |
Kodera R, Miyazaki M, Yoshiiwa T, et al. Manipulation of anabolic and catabolic responses with bone morphogenetic protein and zoledronic acid in a rat spinal fusion model[J]. Bone, 2014, 58: 26-32. DOI:10.1016/j.bone.2013.09.021 |
| [15] |
Bransford R, Goergens E, Briody J, et al. Effect of zoledronic acid in an L6-L7 rabbit spine fusion model[J]. Eur Spine J, 2007, 16(4): 557-562. DOI:10.1007/s00586-006-0212-y |
| [16] |
Jie S, Deng J, Lin C, et al. Curative effect analysis of zoledronic acid in the treatment of postmenopausal osteoporosis with different bone turnover rates[J]. Int J of Clin Med, 2018, 9: 621-628. DOI:10.4236/ijcm.2018.98052 |
| [17] |
周绍波, 冯文强, 江文涛, 等. 内固定术中螺钉稳定性影响因素的研究现状[J]. 中华创伤骨科杂志, 2018, 20(6): 548-552. |
| [18] |
Ding Q, Chen J, Fan J, et al. Effect of zoledronic acid on lumbar spinal fusion in osteoporotic patients[J]. Eur Spine J, 2017, 26(11): 2969-2977. DOI:10.1007/s00586-017-5286-1 |
| [19] |
Natarajan RN, Chen BH, An HS, et al. Anterior cervical fusion:a finite element model study on motion segment stability including the effect of osteoporosis[J]. Spine(Phila Pa 1976), 2000, 25(8): 955-961. DOI:10.1097/00007632-200004150-00010 |
| [20] |
Kwak HB, Kim JY, Kim KJ, et al. Risedronate directly inhibits osteoclast differentiation and inflammatory bone loss[J]. Biol Pharm Bull, 2009, 32(7): 1193-1198. DOI:10.1248/bpb.32.1193 |
| [21] |
Xue Q, Li H, Zou X, et al. Alendronate treatment improves bone-pedicle screw interface fixation in posterior lateral spine fusion:an experimental study in a porcine model[J]. Int Orthop, 2010, 34(3): 447-451. DOI:10.1007/s00264-009-0759-4 |
 2020, Vol.18
2020, Vol.18  Issue(5): 335-338
Issue(5): 335-338


