脊柱内窥镜技术具有手术视野清晰、创伤小、无需进行内固定等优点,得到医患的广泛认可,且术中持续生理盐水冲洗,发生术后感染极少[1-2]。本院2019年7月27日收治1例脊柱内窥镜术后突然出现高热、腰痛患者,常规抗感染治疗疗效不佳,进一步排查确诊为布鲁杆菌性脊柱炎,现报告如下。
1 病例资料患者,女,70岁,脊柱内窥镜术后3周腰痛伴发热5 d入院。患者于3周前因腰椎椎管狭窄症于本院在局部麻醉下行“经皮脊柱内窥镜下单侧椎板入路双侧椎管减压术”,手术顺利,手术时间140 min。术后当天下床活动,5 d出院,无特殊不适。患者于术后3周突发高热,最高体温39.0℃,并伴尿频、尿急及尿痛,就诊于当地诊所,予对症抗炎治疗(具体治疗不详),治疗5 d后患者下腹痛、尿频、尿急及尿痛症状改善,但逐渐出现剧烈腰痛,翻身时明显加重,疼痛视觉模拟量表(VAS)评分[3]7分,遂再次于本院就诊。经门诊医师检查后以“术后感染”收入病房。查体:腰椎可见长约1.5 cm创口,愈合良好,局部无明显红肿热象,术区压痛、叩击痛阳性,其余触诊阴性。实验室检查:白细胞计数4.47×109/L,中性粒细胞百分比58.50%,中性粒细胞绝对值2.61×109/L,超敏C反应蛋白(CRP)45.5 mg/L,血清淀粉样蛋白A(SAA)983.1 mg/L,降钙素原(PCT)0.36 ng/mL。术区体表超声示L4棘突旁术区大小约2.6 cm×1.3 cm×1.1 cm的液性包块,内透声差,挤压有流动感。在超声引导下行腰椎后方积液穿刺,抽取积液为暗红色黏液性血性渗出液,约2 mL,送细菌涂片及培养。细菌涂片回报未见细菌,细菌培养回报未见细菌生长。MRI示腰椎椎管及肌肉组织内积液形成。
根据上述病史、影像学检查及实验室检查结果,诊断为术后感染。入院后予哌拉西林他唑巴坦、亚胺培南西司他丁钠静脉滴注联合利福平口服治疗。治疗期间体温未再次升高,复查白细胞计数4.72×109/L,中性粒细胞百分比42.30%,中性粒细胞绝对值1.99×109/L,CRP 8.7 mg/L,SAA 32.3 mg/L,PCT 0.01 ng/mL;3周后改为氟氯西林、克林霉素降阶治疗,治疗2周后再次出现连续性午后低热,最高体温37.8℃,多出现于15: 00左右,复查MRI示腰椎椎管内积液未见明显增加。详细追问病史得知有羊群密切接触史,虎红平板凝集试验阳性(+),布鲁杆菌凝集试验阳性(++++);结合流行病学、临床表现、影像学、实验室检查结果修正诊断为布鲁杆菌性脊柱炎,予多西环素联合利福平口服。治疗12周后患者体温恢复正常,腰痛症状基本缓解,VAS评分2分,不伴下肢放射痛及间歇性跛行,Oswestry功能障碍指数(ODI)[4]为46%。实验室检查示白细胞计数6.5×109/L,CRP 3.4 mg/L,红细胞沉降率(ESR)21 mm/h,肝肾功能未见明显异常,再次复查MRI示L4,5椎间隙稍塌陷,腰椎椎管内积液量未见明显改变,T2WI呈不均匀稍高信号,同一横截面MRI示L5椎体前方积液较前减少,T2WI呈不均匀等信号。病例影像学资料见图 1。
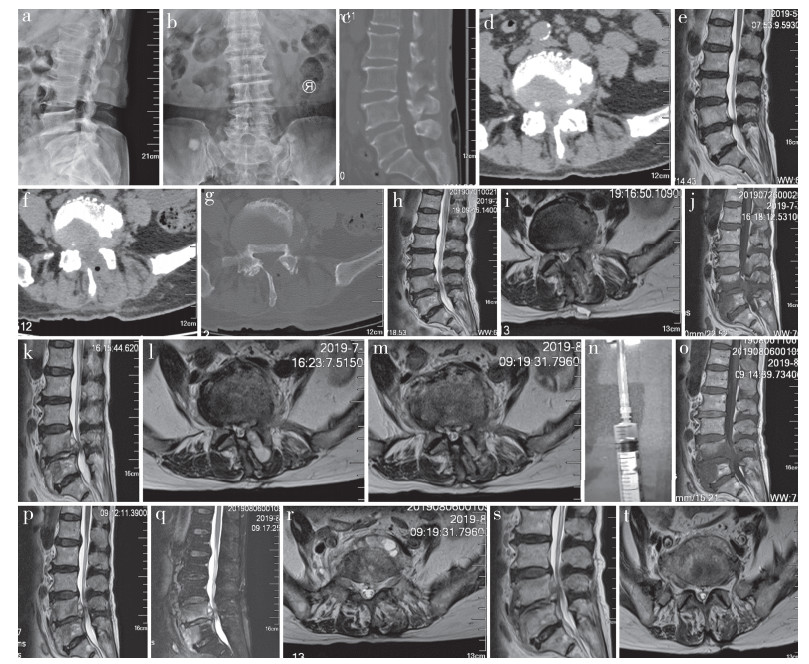
|
a、b:术前X线片示脊柱侧凸,L4,5椎间隙高度丢失伴硬化 c、d:术前CT示L4,5椎管狭窄,骨质增生 e:术前MRI示L4,5椎管狭窄 f~i:内窥镜下行单侧入路双侧减压,术后3 d复查CT示L4部分椎板缺如,其内可见积气,MRI示椎管狭窄较前好转 j~m:术后3周,发热5 d,复查MRI T1WI示L4,5椎体异常信号,伴L5椎体前方异常信号影;T2WI示L4,5椎间隙及椎管内密度浑浊信号影,椎管受累;横断面MRI示L4棘突旁液体信号影,密度不均 n:超声引导下抽取积液约2 mL o~r:术后8周,常规抗感染治疗5周,复查MRI示腰椎术区后方积液减少,椎管内积液未见明显增加,但L5椎体前方可见脓液形成 s、t:抗布鲁杆菌治疗12周后复查MRI示L4,5椎间隙塌陷,椎管内积液未见明显改变,T2WI呈不均匀稍高信号;同一横截面MRI示L5椎体前方积液减少,T2WI呈不均匀等信号 图 1 病例影像学资料 |
分析本例患者诊治经过,造成误诊的原因包括以下几个方面。①病史询问不足。脊柱感染途径包括血源性、邻近组织和直接外部接触[5],其中直接外部接触途径主要为医源性感染。由于惯性思维的影响,在询问患者病史过程中仅根据术后病史诊断为术后感染,忽略了高热患者流行病学中的接触史询问,该患者前后2次住院时间超过1个月,病史询问存在明显欠缺。②实验室检查分析不足。文献报道[6]脊柱内窥镜术后感染多起自椎间隙,由于引流不充分,症状发展迅速,临床可表现为腰痛、寒战、发热(≥38℃)、切口局部红肿热痛伴/不伴脓性渗出等,实验室检查示白细胞、中性粒细胞计数,ESR,CRP及PCT持续升高[7-8]。该患者CRP、ESR、SAA明显升高,但反映非特异性感染指标的白细胞总数、中性粒细胞百分比及中性粒细胞绝对值多次复查未见明显升高,且认为感染灶穿刺活检效率优于血液培养[9],故未进行血培养检查,武断认定是长期应用抗生素控制的结果。有文献报道[10]一旦怀疑患者存在感染,应在开始经验性抗生素治疗之前收集血液和尿液进行细菌培养,59%的血培养可培养出化脓性脊柱炎患者的病原微生物。③影像学资料分析不足。MRI仍是诊断脊柱感染最可靠的方法,有较高的灵敏度(96%)和特异度(94%)[11],并可显示椎旁组织和硬膜外腔感染情况。布鲁杆菌性脊柱炎多首先累及椎体和椎间盘交界处[12],呈不规则“虫蚀”样破坏,伴椎体前方局限性脓肿[13],腰椎受累(60%)比胸椎(19%)和颈椎(12%)更为常见[14]。该患者MRI示棘突旁术区积液及椎管内积液,符合术后感染征象,但对于椎体前方出现脓肿的原因未予深究,忽略了腰椎特异性感染的可能性。
《布鲁氏菌病诊疗指南(试行)》[15]推荐急性期或慢性期的一线治疗方案为多西环素+利福平或多西环素+链霉素治疗6个月。对于椎间盘及椎体骨质明显破坏,椎管内或椎旁、腰大肌较大脓肿形成,脊柱节段不稳定并神经损伤的患者,应在药物治疗的基础上,考虑手术治疗[16-17]。本例患者椎管内存在脓肿且伴椎体前方脓肿形成,首选非手术治疗,原因如下。①患者症状以午后低热、腰痛为主,不伴有下肢神经刺激症状,尚无手术治疗指征;②布鲁杆菌病确诊后,除非有急性、进行性加重的神经压迫症状,宜首先给予规范抗布鲁杆菌治疗,控制并稳定病情。该患者经12周规范非手术治疗后腰痛症状基本消失,未再次出现体温升高,临床症状完全缓解,向患者及家属告知,虽然目前抗布鲁杆菌治疗有效,但存在椎前、椎管内积脓持续增加,后期需行手术清创治疗可能,患者仍在长期随访观察中。
本例患者病情具有一定特殊性。通过对该病例进行分析,本研究组建议一定要坚持辩证思维,避免先入为主,一叶障目,应从病因、临床表现、实验室检查及影像学资料多层面分析,以提高临床诊断准确率,取得更满意的治疗效果。
| [1] |
徐宝山, 马信龙. 腰椎经皮内镜手术的并发症及预防措施[J]. 中华骨科杂志, 2018, 38(8): 504-512. DOI:10.3760/cma.j.issn.0253-2352.2018.08.007 |
| [2] |
商澜镨, 祝斌, 刘晓光. 经皮脊柱内镜腰椎间盘切除术并发症及其应对策略[J]. 中国疼痛医学杂志, 2019, 25(3): 167-171. DOI:10.3969/j.issn.1006-9852.2019.03.004 |
| [3] |
Huskisson EC. Measurement of pain[J]. Lancet, 1974, 2(7889): 1127-1131. |
| [4] |
Fairbank JC, Couper J, Davies JB, et al. The Oswestry low back pain disability questionnaire[J]. Physiotherapy, 1980, 66(8): 271-273. |
| [5] |
Silber JS, Anderson DG, Vaccaro AR, et al. Management of postprocedural discitis[J]. Spine J, 2002, 2(4): 279-287. DOI:10.1016/S1529-9430(02)00203-6 |
| [6] |
Aljawadi A, Jahangir N, Jeelani A, et al. Management of pyogenic spinal infection, review of literature[J]. J Orthop, 2019, 16(6): 508-512. DOI:10.1016/j.jor.2019.08.014 |
| [7] |
Inose H, Kobayashi Y, Yuasa M, et al. Procalcitonin and neutrophil lymphocyte ratio after spinal instrumentation surgery[J]. Spine(Phila Pa 1976), 2019, 44(23): E1356-E1361. DOI:10.1097/BRS.0000000000003157 |
| [8] |
刘键, 陈科, 王先安, 等. 降钙素原联合C反应蛋白在脊柱内固定术后感染早期诊断的临床意义[J]. 中国实验诊断学, 2018, 22(6): 952-955. DOI:10.3969/j.issn.1007-4287.2018.06.006 |
| [9] |
Gasbarrini A, Boriani L, Salvadori C, et al. Biopsy for suspected spondylodiscitis[J]. Eur Rev Med Pharmacol Sci, 2012, 16(Suppl 2): 26-34. |
| [10] |
Choi KB, Lee CD, Lee SH. Pyogenic spondylodiscitis after percutaneous endoscopic lumbar discectomy[J]. J Korean Neurosurg Soc, 2010, 48(5): 455-460. DOI:10.3340/jkns.2010.48.5.455 |
| [11] |
Ledermann HP, Schweitzer ME, Morrison WB, et al. MR imaging findings in spinal infections:rules or myths[J]. Radiology, 2003, 228(2): 506-514. DOI:10.1148/radiol.2282020752 |
| [12] |
Esmaeilnejad-Ganji SM, Esmaeilnejad-Ganji SMR. Osteoarticular manifestations of human Brucellosis:a review[J]. World J Orthop, 2019, 10(2): 54-62. DOI:10.5312/wjo.v10.i2.54 |
| [13] |
蓝旭, 高杰, 许建中, 等. 布氏杆菌性脊柱炎的影像学分型与治疗方案选择[J]. 中国骨与关节损伤杂志, 2017, 32(1): 40-43. |
| [14] |
Erdem H, Elaldi N, Batirel A, et al. Comparison of Brucellar and tuberculous spondylodiscitis patients:results of the multicenter "Backbone-1 study"[J]. Spine J, 2015, 15(12): 2509-2517. DOI:10.1016/j.spinee.2015.09.024 |
| [15] |
中华人民共和国卫生部. 布鲁氏菌病诊疗指南(试行)[J]. 传染病信息, 2012, 25(6): 323-324. DOI:10.3969/j.issn.1007-8134.2012.06.002 |
| [16] |
赵昌松, 张强, 赵汝岗, 等. 一期后路病灶清除植骨融合内固定术治疗腰椎布鲁杆菌性脊柱炎[J]. 脊柱外科杂志, 2019, 17(6): 383-387. |
| [17] |
Chen Y, Yang JS, Li T, et al. One-stage surgical management for lumbar Brucella spondylitis by posterior debridement, autogenous bone graft and instrumentation:a case series of 24 patients[J]. Spine(Phila Pa 1976), 2017, 42(19): E1112-E1118. DOI:10.1097/BRS.0000000000002093 |
 2020, Vol.18
2020, Vol.18  Issue(6): 430-432
Issue(6): 430-432

