跳跃型颈椎椎间盘突出症是多节段颈椎椎间盘退行性疾病的一种特殊类型,其特点是突出的髓核和相应破裂的纤维环突向椎管内致使神经根或脊髓受压而引起相应的临床症状或体征,而2个病变椎间盘之间可见1个或多个正常椎间盘。颈椎前路椎间盘切除融合术(ACDF)于1958年由Smith等[1]首次描述,现已被广泛应用于颈椎椎间盘退行性疾病的手术治疗。目前,非连续多节段ACDF是治疗跳跃型颈椎椎间盘突出症的有效方式,但ACDF可使邻近节段活动度(ROM)减小、椎间盘应力增加,可能导致椎间盘退行性变加速[2-3]。生物力学研究证实,多节段融合术相比于单节段融合术对邻近节段的影响更为显著[4]。此外,跳跃型颈椎椎间盘突出症患者的中间正常节段在非连续ACDF术后可能承受更大的压力,相关研究也提示该术式加速了中间节段的退行性变[5-6]。也有学者报道,使用连续多节段ACDF治疗跳跃型颈椎椎间盘退行性疾病,术后假关节形成率高,且ROM下降,临床效果较差,并且牺牲了正常的中间节段[7]。同时,相比于Zero-P系统,传统椎间融合术中钢板/钛板的使用也增加了邻近节段骨化和术后吞咽困难的风险[8-9],多节段者尤甚[10]。
近年来,人工颈椎椎间盘置换术(CDA)已被证明可有效恢复椎间隙高度,保留手术节段ROM,延缓甚至避免邻近节段退行性变[11-12]。多项生物力学研究表明,CDA术后邻近节段ROM及椎间盘应力与术前相似[12-15]。因此,CDA理论上可用于治疗跳跃型颈椎椎间盘突出症。但是,既往生物力学研究多为单节段或连续双节段CDA,其结论可能不适用于跳跃型CDA,且术后中间节段的生物力学改变尚不清楚。本研究通过有限元分析观察跳跃型颈椎椎间盘突出行ACDF和CDA后的生物力学改变情况,为治疗跳跃型颈椎椎间盘突出症的术式选择提供生物力学依据。
1 材料与方法 1.1 建立颈椎模型利用薄层CT(扫描层厚0.75 mm,层距0.69 mm)扫描健康成年志愿者(男,28岁,身高165 cm,体质量65 kg)颈椎(C2~7)并收集dicom格式影像学数据。使用Mimics 17.0软件建立C2~7三维模型,并以stl格式将其依次导入Geomagic 12.0、CATIA v5r21、Hypermesh 12.0软件,完成模型的打磨、填充、去噪、切割、光顺及网格划分等前处理工作。最后将数据导入ABAQUS 6.9.1有限元分析软件,完成正常颈椎有限元模型的建立。综合前期研究及其他学者报道[16-18],对有限元模型进行单元设置、材料属性定义(表 1)及模型单元数和节点数设定(表 2)。同时,在此有限元模型中使用0.4 mm的壳单元模拟皮质骨和终板,并将椎间盘以3∶2的比例分为纤维环和髓核2部分[16-17]。将环状纤维以约19%的体积比嵌入纤维环基质中,设定其相邻交角范围为15°~30°[17]。将小关节间隙定义为0.5 mm,每个关节突上使用非线性表面接触的关节软骨层覆盖[16]。此外,所有的韧带定义为仅保持张力而无压力特征的线性单元。使用CAD软件设计跳跃ACDF(Zero-P系统,Synthes公司,瑞士)和跳跃CDA(Prestige-LP系统,Medtronic Sofamor Danek公司,美国)模型(图 1)。
|
|
表 1 颈椎有限元模型的材料属性和网格类型 Tab. 1 Material properties and mesh types of cervical finite element model |
|
|
表 2 颈椎模型的单元数和节点数 Tab. 2 Number of elements and nodes for cervical mode |

|
图 1 C2~7有限元模型及内置物模型 Fig. 1 Finite element of C2-7 and device models |
本模型采用的加载条件及边界条件参考文献[18-20]。对有限元模型最下端的C7椎体下表面节点各方向进行约束,设定自由度为6°。将正常椎间盘与相邻终板接触部分之间定义为绑定关系,小关节面之间定义为无摩擦接触关系。在跳跃ACDF模型中,将Zero-P系统填满松质骨,同时设定融合器与椎体的接触摩擦系数为0.3[19]。在跳跃CDA模型中,设定Prestige-LP假体上、下板间的接触摩擦系数为0.07[20]。最后,将椎体终板与置入物接触部分之间定义为绑定关系,默认置入物与骨界面达到完全融合状态,在有限元分析过程中不会产生相对位移[18]。加载条件:在C2上施加模拟头部重量的75 N预载荷,运动附加力矩1.0 N·m。本课题组既往研究[21]发现,C3/C4和C5/C6是跳跃型颈椎椎间盘突出症最常累及的节段,故将其设定为模拟手术节段。在跳跃ACDF模型和跳跃CDA模型中,分别将Zero-P系统和Prestige-LP假体置入相应节段建立手术模型。切除C3/C4和C5/C6的前纵韧带、后纵韧带、椎间盘髓核和纤维环,保留钩突关节等其他结构以模拟手术操作。
2 结果 2.1 正常颈椎三维有限元模型有效性验证正常颈椎三维有限元模型C2/C3、C3/C4、C4/C5、C5/C6和C6/C7节段ROM在前屈时分别为4.25°、6.59°、7.47°、7.36°和4.94°,后伸时分别为3.19°、4.62°、6.21°、5.25°和4.18°,侧曲时分别为5.17°、5.46°、5.66°、4.12°和3.83°,旋转时分别为2.11°、3.12°、4.39°、3.65°和2.02°(图 2)。该模型在前屈、后伸、侧曲及旋转4个方向ROM与既往研究[22-24]近似,可认为该模型设计合理,能够有效地模拟颈椎的生理运动,可用于实验。
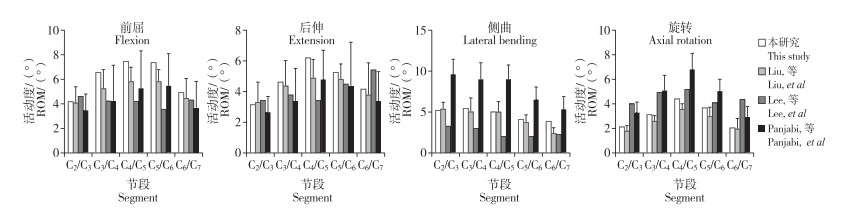
|
图 2 有限元模型在不同方向的ROM及与研究[22-24]的比较 Fig. 2 ROM of finite element model in different directions of motions and comparison to studies[22-24] |
在跳跃ACDF模型中,融合节段(C3/C4和C5/C6)ROM明显下降。与正常颈椎模型相比,术后C3/C4各方向ROM在前屈、后伸、侧曲和旋转方向上分别下降85.9%、80.1%、83.2%和69.6%,在C5/C6节段分别下降84.1%、86.3%、81.6%和74.0%(图 3)。
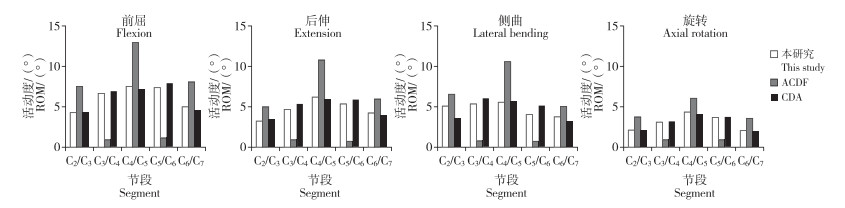
|
图 3 ACDF和CDA模型中各节段不同运动方向ROM Fig. 3 Segmental ROM in different directions of motions in ACDF and CDA models |
在跳跃CDA模型中,置换节段(C3/C4和C5/C6)ROM与正常颈椎模型相似。与正常颈椎模型相比,术后C3/C4节段各方向ROM在前屈、后伸、侧曲和旋转方向上分别增加3.9%、16.2%、12.1%和3.2%,在C5/C6节段分别增加6.9%、12.8%、27.7%和4.6%(图 3)。
2.3 邻近节段ROM在跳跃ACDF模型中,与正常颈椎模型相比,上邻近节段(C2/C3)ROM在前屈、后伸、侧曲和旋转方向上分别增加76.9%、58.3%、29.0%和77.7%,其中旋转增加幅度最大;中间节段(C4/C5)各方向ROM增加73.5%、73.6%、89.2%和39.4%,其中侧曲增加幅度最大;下邻近节段(C6/C7)各方向ROM增加62.6%、43.8%、35.2%和74.3%,其中旋转增加幅度最大(图 3)。
在跳跃CDA模型中,与正常颈椎模型相比,上邻近节段(C2/C3)ROM在后伸方向上增加了0.5%,在前屈、侧曲及旋转方向上分别减少0.5%、28.8%和1.4%;中间节段(C4/C5)ROM在侧曲方向上增加了0.3%,在前屈、后伸及旋转方向上分别减少3.5%、5.5%和5.2%;下邻近节段(C6/C7)ROM则在前屈、后伸、侧曲及旋转方向上分别减少9.9%、5.9%、12.5%和0.5%(图 3)。
2.4 邻近节段椎间盘应力邻近节段椎间盘应力云图如图 4所示。在正常颈椎三维有限元模型中,在前屈、后伸、侧曲及旋转力矩作用下,C2/C3节段椎间盘应力分别为0.21、0.23、0.35和0.38 MPa,C4/C5节段分别为0.26、0.25、0.38和0.42 MPa,C6/C7节段分别为0.24、0.25、0.39和0.40 MPa。

|
图 4 非手术节段椎间盘应力云图 Fig. 4 Stress cloud diagram of non-operative segments |
在跳跃ACDF模型中,与正常颈椎模型相比,在前屈、后伸、侧曲及旋转力矩作用下,C2/C3节段椎间盘应力分别增加66.7%、52.2%、62.9%和63.2%,C4/C5节段分别增加61.5%、68.0%、71.0%和69.0%,C6/C7节段分别增加79.2%、80.0%、69.2%和72.5%(图 5)。
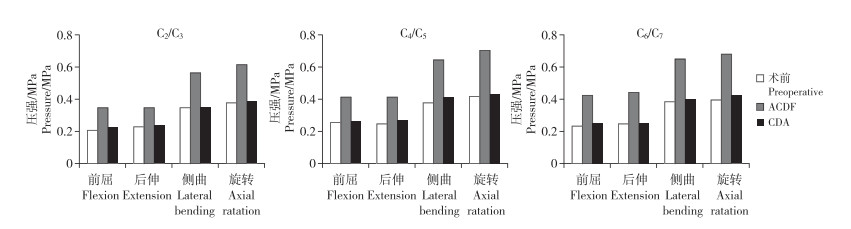
|
图 5 非手术节段椎间盘应力 Fig. 5 Stress of non-operative segments |
在跳跃CDA模型中,与正常颈椎模型相比,在前屈、后伸、侧曲及旋转力矩作用下,C2/C3节段椎间盘应力分别增加9.5%、4.3%、5.4%和2.6%,C4/C5节段分别增加3.8%、8.0%、10.5%和4.7%,C6/C7节段分别增加8.3%、4.0%、5.1%和7.5%(图 5)。
2.5 邻近节段小关节压力在后伸状态下记录C2/C3、C4/C5和C6/C7的最大小关节压力。在正常颈椎三维有限元模型中,C2/C3、C4/C5和C6/C7的最大小关节压力分别为70.57、77.39和76.71 N。与正常模型相比,跳跃ACDF模型中C2/C3、C4/C5和C6/C7的最大小关节压力分别增加36.5%、54.2%和37.4%;跳跃CDA模型中C2/C3的最大小关节压力减少了13.0%,C4/C5和C6/C7的最大小关节压力分别增加6.4%和7.6%(图 6)。
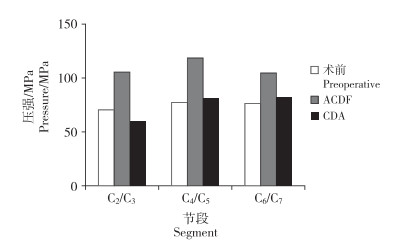
|
图 6 后伸状态下最大小关节压力 Fig. 6 Maximum force of facet joint in extension |
颈椎融合术后邻近节段常发生退行性变,其原因尚未完全明确。已有研究发现,融合后邻近节段异常的椎间盘应力水平可能是导致退行性变的重要因素之一[25]。椎间盘内的非血管营养交换主要取决于营养物质自由扩散和渗透梯度。Arun等[26]的研究证实,持续增加的机械负荷会阻滞上述营养物质自由扩散入椎间盘,导致椎间盘退行性变加速。此外,Matsumoto等[3]对ACDF术后的64例患者和201例健康志愿者进行为期10年的前瞻性研究证明,ACDF患者和健康志愿者在10年内均表现出进行性的椎间盘退行性变,但ACDF患者邻近节段椎间盘退行性变的发生率显著高于健康人群。因此,相较于单个融合节段的邻近节段,位于3个融合节段之间的中间节段发生退行性变的风险可能更高。
本研究中,跳跃ACDF模型的非手术节段前屈与后伸ROM增加程度近似,而侧曲和旋转的ROM增加程度则不同,同时中间节段侧曲ROM增量远远大于上、下邻近节段。该结果与Finn等[25]的尸体研究结果一致,表明融合手术对不同非手术节段的运动学效应不同。此外,在跳跃ACDF模型中,非手术节段的椎间盘应力也显著增加。ACDF术后邻近节段因屈伸、侧曲ROM增加,椎间盘应力增加,该结果与Watanabe等[27]的研究结果相符,提示该术式可能导致邻近节段退行性变加速。再者,本研究发现跳跃ACDF模型中间节段小关节压力增量约为上、下邻近节段的1.5倍,而异常的负荷已被证明与小关节退行性变有关[28],提示ACDF用于治疗跳跃型颈椎椎间盘突出症时,中间节段小关节可能较其他非手术节段退行性变加速。小关节退行性变是引起颈部疼痛的主要原因之一,其可能导致患者术后颈痛发生率增加。
从设计理念上,CDA可保留手术节段的运动功能,降低邻近椎间盘应力。多项生物力学研究证实,CDA具有优越的运动学和生物力学性能,但其中大多数研究只针对单节段或连续双节段CDA[12-15]。由于连续双节段CDA与跳跃型CDA机制不同,前者的研究结论能否适用于后者有待进一步验证。本研究结果显示,跳跃CDA模型手术节段各方向ROM均轻度增加,非手术节段各方向ROM多呈轻度减少,该结果与Lee等[22]的CDA有限元研究结果一致,也与既往临床研究中所观测到的临床现象相符[21, 29]。这提示跳跃型CDA同样具有保留手术节段运动功能的作用。另一方面,Dmitriev等[15]的研究指出,CDA可维持手术邻近节段正常的椎间盘应力。在本研究跳跃CDA模型中,中间节段椎间盘应力无明显增加,而跳跃ACDF模型中间节段的椎间盘应力明显增加,表明CDA对手术相邻节段生物力学环境的影响小于ACDF,可有效降低中间节段椎间盘退行性变的风险。
本研究的不足:首先,本研究为有限元研究,其证据等级较低。其次,上述实验的结果是基于C3/C4和C5/C6作为手术节段建立模型,而当病变节段间隔2个及以上椎间盘或中间节段不是C4/C5时,模型的生物力学特性可能不同。再者,本研究简化了多项参数,如材料特性、边界条件、无摩擦接触、肌肉骨骼系统和置入位置等,该理想条件下的结果不能完全反映实际手术后的情况。同时,该模型简化了手术本身的操作影响,包括置入前对椎骨的操作,如椎骨撑开、终板打磨等,这也与实际临床工作不完全符合。最后,本研究主要针对各节段椎间盘和椎间关节,忽略了假体和各节段椎体受力情况,其临床意义需要进一步研究。因此,目前的结果只能为临床提供生物力学的参考。
综上所述,本研究发现跳跃型颈椎椎间盘突出症CDA术后颈椎各节段的生物力学和运动学特性与正常颈椎相似,中间节段各方向ROM、椎间盘应力和小关节压力无明显改变,提示CDA有保留中间节段生物力学和运动学特性的作用,为采用CDA治疗跳跃型颈椎椎间盘突出症提供了生物力学依据。
| [1] |
Smith GW, Robinson RA. The treatment of certain cervical-spine disorders by anterior removal of the intervertebral disc and interbody fusion[J]. J Bone Joint Surg Am, 1958, 40-A(3): 607-624. |
| [2] |
Hilibrand AS, Carlson GD, Palumbo MA, et al. Radiculopathy and myelopathy at segments adjacent to the site of a previous anterior cervical arthrodesis[J]. J Bone Joint Surg Am, 1999, 81(4): 519-528. DOI:10.2106/00004623-199904000-00009 |
| [3] |
Matsumoto M, Okada E, Ichihara D, et al. Anterior cervical decompression and fusion accelerates adjacent segment degeneration: comparison with asymptomatic volunteers in a ten-year magnetic resonance imaging follow-up study[J]. Spine(Phila Pa 1976), 2010, 35(1): 36-43. DOI:10.1097/BRS.0b013e3181b8a80d |
| [4] |
Prasarn ML, Baria D, Milne E, et al. Adjacent-level biomechanics after single versus multilevel cervical spine fusion[J]. J Neurosurg Spine, 2012, 16(2): 172-177. DOI:10.3171/2011.10.SPINE11116 |
| [5] |
Shi S, Liu Z, You W, et al. Application of a stand-alone anchored spacer in noncontiguous anterior cervical arthrodesis with radiologic analysis of the intermediate segment[J]. J Clin Neurosci, 2016, 25: 69-74. DOI:10.1016/j.jocn.2015.05.050 |
| [6] |
Wang HR, Li XL, Dong J, et al. Skip-level anterior cervical discectomy and fusion with self-locking stand-alone PEEK cages for the treatment of 2 noncontiguous levels of cervical spondylosis[J]. J Spinal Disord Tech, 2013, 26(7): E286-E292. DOI:10.1097/BSD.0b013e31828679b3 |
| [7] |
Emery SE, Fisher JR, Bohlman HH. Three-level anterior cervical discectomy and fusion: radiographic and clinical results[J]. Spine(Phila Pa 1976), 1997, 22(22): 2622-2624. DOI:10.1097/00007632-199711150-00008 |
| [8] |
Xiao S, Liang Z, Wei W, et al. Zero-profile anchored cage reduces risk of postoperative dysphagia compared with cage with plate fixation after anterior cervical discectomy and fusion[J]. Eur Spine J, 2017, 26(4): 975-984. DOI:10.1007/s00586-016-4914-5 |
| [9] |
Chen Y, Chen H, Wu X, et al. Comparative analysis of clinical outcomes between zero-profile implant and cages with plate fixation in treating multilevel cervical spondilotic myelopathy: a three-year follow-up[J]. Clin Neurol Neurosurg, 2016, 144: 72-76. DOI:10.1016/j.clineuro.2016.03.010 |
| [10] |
马骏雄, 陈语, 项良碧, 等. 单节段和双/多节段颈椎前路减压融合术后椎前软组织肿胀及吞咽困难发生率的比较[J]. 脊柱外科杂志, 2015, 13(1): 41-44. DOI:10.3969/j.issn.1672-2957.2014.10.13 |
| [11] |
Gornet MF, Lanman TH, Burkus JK, et al. Two-level cervical disc arthroplasty versus anterior cervical discectomy and fusion: 10-year outcomes of a prospective, randomized investigational device exemption clinical trial[J]. J Neurosurg Spine, 2019, 31(4): 508-518. DOI:10.3171/2019.4.SPINE19157 |
| [12] |
Welke B, Schwarze M, Hurschler C, et al. In vitro investigation of a new dynamic cervical implant: comparison to spinal fusion and total disc replacement[J]. Eur Spine J, 2016, 25(7): 2247-2254. DOI:10.1007/s00586-015-4361-8 |
| [13] |
Zhao X, Yuan W. Biomechanical analysis of cervical range of motion and facet contact force after a novel artificial cervical disc replacement[J]. Am J Transl Res, 2019, 11(5): 3109-3115. |
| [14] |
Lou J, Li Y, Wang B, et al. Biomechanical evaluation of cervical disc replacement with a novel prosthesis based on the physiological curvature of endplate[J]. J Orthop Surg Res, 2018, 13(1): 41-48. DOI:10.1186/s13018-018-0748-7 |
| [15] |
Dmitriev AE, Cunningham BW, Hu N, et al. Adjacent level intradiscal pressure and segmental kinematics following a cervical total disc arthroplasty: an in vitro human cadaveric model[J]. Spine(Phila Pa 1976), 2005, 30(10): 1165-1172. DOI:10.1097/01.brs.0000162441.23824.95 |
| [16] |
Rong X, Wang B, Ding C, et al. The biomechanical impact of facet tropism on the intervertebral disc and facet joints in the cervical spine[J]. Spine J, 2017, 17(12): 1926-1931. DOI:10.1016/j.spinee.2017.07.009 |
| [17] |
Denozière G, Ku DN. Biomechanical comparison between fusion of two vertebrae and implantation of an artificial intervertebral disc[J]. J Biomech, 2006, 39(4): 766-775. DOI:10.1016/j.jbiomech.2004.07.039 |
| [18] |
陈群响, 倪斌, 郭群峰, 等. 带肌肉组织全颈椎三维有限元模型的建立及分析[J]. 中国脊柱脊髓杂志, 2019, 29(4): 348-355. DOI:10.3969/j.issn.1004-406X.2019.04.09 |
| [19] |
Galbusera F, Bellini CM, Costa F, et al. Anterior cervical fusion: a biomechanical comparison of 4 techniques. Laboratory investigation[J]. J Neurosurg Spine, 2008, 9(5): 444-449. DOI:10.3171/SPI.2008.9.11.444 |
| [20] |
Li Y, Fogel GR, Liao Z, et al. Prosthesis and hybrid strategy consideration for treating two-level cervical disc degeneration in hybrid surgery[J]. Spine(Phila Pa 1976), 2018, 43(6): 379-387. DOI:10.1097/BRS.0000000000002316 |
| [21] |
吴廷奎, 王贝宇, 孟阳, 等. Prestige-LP人工椎间盘置换术治疗跳跃型颈椎椎间盘突出症[J]. 脊柱外科杂志, 2017, 15(4): 193-199. DOI:10.3969/j.issn.1672-2957.2017.04.001 |
| [22] |
Lee JH, Park WM, Kim YH, et al. A biomechanical analysis of an artificial disc with a shock-absorbing core property by using whole-cervical spine finite element analysis[J]. Spine(Phila Pa 1976), 2016, 41(15): E893-E901. DOI:10.1097/BRS.0000000000001468 |
| [23] |
Panjabi MM, Crisco JJ, Vasavada A, et al. Mechanical properties of the human cervical spine as shown by three-dimensional load-displacement curves[J]. Spine(Phila Pa 1976), 2001, 26(24): 2692-2700. DOI:10.1097/00007632-200112150-00012 |
| [24] |
Liu Q, Guo Q, Yang J, et al. Subaxial cervical intradiscal pressure and segmental kinematics following atlantoaxial fixation in different angles[J]. World Neurosurg, 2016, 87: 521-528. DOI:10.1016/j.wneu.2015.09.025 |
| [25] |
Finn MA, Samuelson MM, Bishop F, et al. Two-level noncontiguous versus three-level anterior cervical discectomy and fusion[J]. Spine(Phila Pa 1976), 2011, 36(6): 448-453. DOI:10.1097/BRS.0b013e3181fd5d7c |
| [26] |
Arun R, Freeman BJ, Scammell BE, et al. 2009 ISSLS prize winner: what influence does sustained mechanical load have on diffusion in the human intervertebral disc?: an in vivo study using serial postcontrast magnetic resonance imaging[J]. Spine(Phila Pa 1976), 2009, 34(21): 2324-2337. DOI:10.1097/BRS.0b013e3181b4df92 |
| [27] |
Watanabe S, Inoue N, Yamaguchi T, et al. Three-dimensional kinematic analysis of the cervical spine after anterior cervical decompression and fusion at an adjacent level: a preliminary report[J]. Eur Spine J, 2012, 21(5): 946-955. DOI:10.1007/s00586-011-2090-1 |
| [28] |
Rong X, Liu Z, Wang B, et al. The facet orientation of the subaxial cervical spine and the implications for cervical movements and clinical conditions[J]. Spine (Phila Pa 1976), 2017, 42(6): E320-E325. DOI:10.1097/BRS.0000000000001826 |
| [29] |
Lanman TH, Burkus JK, Dryer RG, et al. Long-term clinical and radiographic outcomes of the Prestige LP artificial cervical disc replacement at 2 levels: results from a prospective randomized controlled clinical trial[J]. J Neurosurg Spine, 2017, 27(1): 7-19. DOI:10.3171/2016.11.SPINE16746 |
 2021, Vol.19
2021, Vol.19  Issue(1): 38-45
Issue(1): 38-45


