在脊柱外科手术中,术后视力丧失(PVL)是一种极为罕见但常导致灾难性后果的并发症。PVL最早由Slocum等[1]于1948年提出,主要表现为术后视力、视野的丧失。据国外文献[2]报道,在非眼科手术中,PVL的发生率仅为0.000 8% ~ 0.003 0%,但在脊柱手术中达0.2%。然而,许多脊柱外科医师对这一并发症仍较为陌生。本院收治1例颈椎术后疑似因视网膜中央动脉阻塞导致的PVL病例,经治疗后患者视力不完全扭转,本研究通过分析该病例的诊疗过程,探讨颈椎术后发生PVL的原因及预防措施,现报告如下。
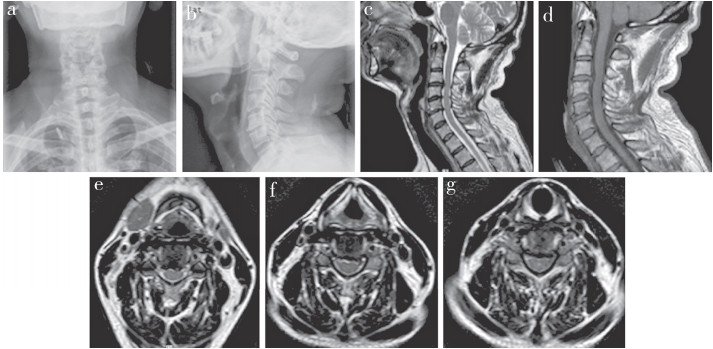
1 病例资料及诊治经过患者,男,56岁,2015年7月17日因“左上肢乏力2个月”就诊。入院时询问病史,患者无左上肢麻木、放射痛,无头晕、头痛、胸腹部束带感、脚踩棉花感、听力减退等症状,二便正常。双眼视力5.0,双侧瞳孔等大等圆,直径约3 mm,对光反射灵敏。患者有高血压病史3年,血压最高达160/100 mmHg(1 mmHg = 0.133 kPa),长期规范口服降压药物治疗,血压控制可,无糖尿病及周围神经病变史。入院查体:左上肢肌力减退,感觉正常,双上肢病理征(±),双上肢肌张力略增高。实验室检查:肝肾功能、血常规、电解质、凝血功能未见明显异常。颈椎正侧位X线片及MRI示颈椎椎间盘突出、颈椎椎管狭窄症(图 1)。
|
a、b:颈椎正侧位X线片示椎体边缘轻度骨质增生,颈椎后方项韧带条状钙化c、d:颈椎MRI示C3/C4/C5/C6椎间盘向后突出,压迫相应水平硬膜囊及脊髓e ~ g:颈椎MRI示C3~6节段双侧钩椎关节增生,相应水平椎间孔狭窄,神经根受压 图 1 病例术前影像学资料 |
完善相关检查后患者于入院后第5天在全身麻醉下行后路颈椎单开门椎管扩大椎板成形术。手术过程顺利,手术时间约135 min,术中出血量约200 mL,术中未予输血。麻醉苏醒后患者主诉右眼眼睑无法上抬、无光感。查体:右眼视力丧失、无光感,眼球不能活动,直接对光反射消失,间接对光反射存在。眼科会诊后检查发现视网膜呈灰白缺血状态,考虑为视网膜中央动脉缺血,动眼神经损伤。立即予以吸氧、按摩眼球、降低眼压、前列地尔扩血管、甲泼尼龙琥珀酸钠0.5 g冲击、营养神经等治疗。眼部及椎动脉彩超提示视网膜中央动脉、右侧睫状后短动脉及椎动脉血管阻力增高。眼部MRI示眼外肌肿胀,未见明显器质性病变。术后第2天,患者视力及光感逐渐恢复,使用甲泼尼龙琥珀酸钠40 mg维持治疗,1周后检查右眼视力(手动/眼前)光感基本恢复,但较对侧仍偏弱,眼部水肿消退,眼球活动自如。术后3年回访,视力同出院前。
2 讨论 2.1 PVL发生机制目前,PVL的发生机制仍不明确。国内外文献报道的PVL发生机制[3-7]:①缺血性视神经病变;②视网膜中央动脉阻塞[3];③皮质盲(由枕叶皮质缺血性卒中引起的视神经损伤导致,头颅MRI可见梗死灶[4]);④可逆性后部脑病综合征。其中,缺血性视神经病变被认为是脊柱术后发生PVL的主要原因,约占80%[5],而视网膜中央动脉阻塞位列第二,约占11%[6]。本例患者术后右眼视力丧失,无光感,直接对光反射消失,查体可见视网膜呈灰白缺血状态。影像学检查显示视网膜中央动脉、右侧睫状后短动脉及椎动脉血管阻力增高,眼外肌肿胀。高度考虑为视网膜中央动脉阻塞[7],但缺乏相关证据支持。
2.2 危险因素虽然PVL的发生机制仍不明确,但是国内外文献总结了许多其围手术期的危险因素,可能原因如下。①性别,虽然男性和女性的视神经在解剖结构上没有显著差异,但有研究[8]表明,发生PVL的患者中,男性更为常见,可能原因为雌激素对视神经具有一定的保护作用。②体质量,已有研究[9]表明,体质量指数(BMI)≥30 kg/m2的患者在接受脊柱手术时发生PVL的风险会相对增高,同时,腹围增加会使腹部受压,从而导致腹内压及中心静脉压增高,进而导致头部静脉压增高。③合并基础疾病,术前合并青光眼、老年黄斑变性、糖尿病视网膜病变、高血压视网膜病变、动脉粥样硬化、颈动脉狭窄等的患者,术后PVL发生率会大大增高,因为上述疾病常常会导致视神经的缺血[10]。④年龄,有研究[11]表明,年龄低于18岁的患者,发生PVL的可能性增加,并且与成年人不同,青少年PVL常由皮质盲引起,随着年龄的增长,视神经纤维逐年减少,因此,相较于青年患者,老年患者也更容易发生PVL。⑤手术体位,俯卧位时眼部的机械压迫无法避免,已有研究[12]表明,对于眼球的直接压迫可导致眼内压增高,灌注压降低,进而导致PVL发生。手术时,若无法避免采用俯卧位,可适当保持头高脚低位以维持眼部的血流供应。⑥手术时间及术中出血量,手术时间 > 6 h,术中出血量 > 1 000 mL都是导致PVL的高危因素。出血量过多会导致毛细血管渗漏、间质性水肿和全身的炎性反应,同时也会导致心输出量下降,末梢血供不足[9]。机体长时间处于该病理状态无疑会加大发生意外的可能性。术中补充适量的胶体可减轻视神经周围水肿,降低PVL发生风险。⑦术中低血压及贫血,有研究[13]表明,术中低血压与PVL密切相关,因此,保持术中液体平衡显得极为重要。术中根据手术切口及出血量选择性地输注液体或血液制品,将患者血压维持在正常水平。贫血状态下,机体的氧运输受阻,视神经缺氧,从而导致PVL的发生。术中血红蛋白≥80 g/L可不予输血[14]。⑧头架,使用马蹄形头架会压迫眼眶,导致眼内压增高,增加PVL发生风险,使用Mayfield头架,同时在眼部周围辅以软垫,能够避免眼部受压,在一定程度上降低PVL发生风险。⑨术后补液量,有研究[15]表明,术后过多补液也在PVL的发生中起着重要作用。在发生PVL的患者中,平均晶体补液量达9 700 mL,而该数据在未发生PVL的患者中为4 600 mL,输注过多的晶体可导致眼球灌注压及红细胞压积降低,两者共同导致PVL的发生。因此,对于需要大量液体输注的患者,术中需监测中心静脉压。⑩手术节段,根据美国麻醉师协会统计,约有90%的PVL患者手术节段超过1个[5],该研究表明,接受多节段融合的患者更容易发生PVL。
本例患者为中老年男性,既往无眼部相关疾病,考虑可能是手术时头部使用马蹄形头架固定,周围缺乏软垫保护,眼部受压,眼内压增高,视网膜中央动脉灌注不足,从而导致视网膜中央动脉阻塞。综上,虽然上述因素可增加PVL的发生风险,但即使避免了所有危险因素,也不能完全避免其发生,明确危险因素可有针对性地对患者进行手术前宣教。
2.3 治疗方式PVL患者视力恢复的可能性很低,如病因是视网膜中央动脉阻塞,约60%的患者将永久性失明,仅有不到25%的患者可恢复有效视力[3]。对于术后出现视力、视野损伤的患者,一旦发现,应尽快请眼科会诊,明确病因。排除神经系统相关疾病后,需警惕PVL的发生。目前,仍然没有相关的治疗指南可供参考,常规的治疗包括大剂量糖皮质激素冲击、甘露醇脱水及抗凝治疗,但效果都不太理想。有研究[16]对1例考虑为缺血性视神经病变的PVL患者予以甲钴胺、神经节苷脂、维生素B12、维生素B1、维生素C、血栓通注射剂、右旋糖苷联合治疗,取得理想疗效。视网膜中央动脉阻塞患者,不推荐经眼动脉局部使用纤溶药物,可以早期使用高压氧治疗,能明显改善预后[17]。其他治疗还包括静脉应用乙酰唑胺、甘露醇、甲泼尼龙、组织型纤溶酶原激活剂(t-PA),辅以眼部按摩等降低眼压的措施,必要时也可采用手术治疗[18]。有研究[19]报道,1例考虑为视网膜中央动脉阻塞的PVL患者,单独使用糖皮质激素治疗,眼外肌运动功能明显改善,但视力改善效果不明显。本例患者采用吸氧、按摩眼球、降低眼压、前列地尔扩血管、甲泼尼龙琥珀酸钠冲击、营养神经等治疗,视力及光感逐渐恢复,眼部水肿消退,眼球活动自如,与上述研究结果一致。
2.4 预防策略在脊柱手术中,虽然PVL发生率很低,但一旦发生,常导致灾难性后果。鉴于目前尚无有效治疗措施,所以术前预防极为重要。对于高危患者,国外学者建议使用以下策略进行预防[20]。①术前询问患者视力情况,如存在视力异常,需要进行术前评估。②术前讨论发生PVL的风险(脊柱手术PVL发生率为0.1% ~ 0.2%)。③确定潜在相关危险因素,包括动脉粥样硬化疾病的危险因素(高血压、高脂血症、糖尿病)和血栓栓塞的危险因素(先天性心脏病)。④术前停用治疗勃起功能障碍药物(西地那非)。⑤放置手术体位时须注意避免眼部直接受压;俯卧位手术时使用适当的头位工具;尽可能避免俯卧位和头低脚高位,并采用适当的头高位;保持眼部循环畅通,手术中15 ~ 30 min检查1次。⑥术中做好液体管理,包括合理应用胶体,长时间复杂手术应监测中心静脉压。⑦术中进行有创动脉压监测,注意维持术中血流动力学稳定。⑧手术时间长和术中出血量大的手术应监测血红蛋白。⑨维持正常的CO2分压,术中避免意外性过度通气。⑩高危手术后进行视力评估。⑪在临床可行的情况下,手术后采用头高位(30° ~ 45°),以减少眶内水肿。
综上所述,PVL作为脊柱手术后罕见的并发症之一,应引起临床医师的高度重视。对于术前存在危险因素的患者,术前宣教非常必要,术中注意保持血流动力学稳定,同时避免眼球直接受压,争取将术后视力丧失的发生率降至最低。对于已经发生视力丧失的患者,应立即请求眼科会诊,明确病因。一旦确诊,可尝试使用糖皮质激素、甘露醇、乙酰唑胺等治疗,争取尽早恢复有效视力。
| [1] |
Slocum HC, O'neal KC, Allen CR. Neurovascular complications from malposition on the operating table[J]. Surg Gynecol Obstet, 1948, 86(6): 729-734. |
| [2] |
Shen Y, Drum M, Roth S. The prevalence of perioperative visual loss in the United States: a 10-year study from 1996 to 2005 of spinal, orthopedic, cardiac, and general surgery[J]. Anesth Analg, 2009, 109(5): 1534-1545. DOI:10.1213/ane.0b013e3181b0500b |
| [3] |
Nickels TJ, Manlapaz MR, Farag E. Perioperative visual loss after spine surgery[J]. World J Orthop, 2014, 5(2): 100-106. DOI:10.5312/wjo.v5.i2.100 |
| [4] |
Gupta A, Srivastava U, Dwivedi P, et al. Post-operative visual loss: an unusual complication after exploratory laparotomy[J]. Indian J Anaesth, 2013, 57(2): 206-207. DOI:10.4103/0019-5049.111874 |
| [5] |
Lee LA, Roth S, Posner KL, et al. The American society of anesthesiologists postoperative visual loss registry: analysis of 93 spine surgery cases with postoperative visual loss[J]. Anesthesiology, 2006, 105(4): 652-659. DOI:10.1097/00000542-200610000-00007 |
| [6] |
Haushofer L, Bhattacharyya M, Isibor RN, et al. Does conventional practice prevent occular complications in prone position spinal surgery?[J]. J Perioper Pract, 2009, 19(1): 16-19. DOI:10.1177/175045890901900101 |
| [7] |
Uribe AA, Baig MN, Puente EG, et al. Current intraoperative devices to reduce visual loss after spine surgery[J]. Neurosurg Focus, 2012, 33(2): E14. DOI:10.3171/2009.8.FOCUS09151 |
| [8] |
Kla KM, Lee LA. Perioperative visual loss[J]. Best Pract Res Clin Anaesthesiol, 2016, 30(1): 69-77. DOI:10.1016/j.bpa.2015.11.004 |
| [9] |
Postoperative Visual Loss Study Group. Risk factors associated with ischemic optic neuropathy after spinal fusion surgery[J]. Anesthesiology, 2012, 116(1): 15-24. DOI:10.1097/ALN.0b013e31823d012a |
| [10] |
Rubin DS, Matsumoto MM, Moss HE, et al. Ischemic optic neuropathy in cardiac surgery: incidence and risk factors in the United States from the national inpatient sample 1998 to 2013[J]. Anesthesiology, 2017, 126(5): 810-821. DOI:10.1097/ALN.0000000000001533 |
| [11] |
Garza-Ramos RDL, Samdani AF, Sponseller PD, et al. Visual loss after corrective surgery for pediatric scoliosis: incidence and risk factors from a nationwide database[J]. Spine J, 2016, 16(4): 516-522. DOI:10.1016/j.spinee.2015.12.031 |
| [12] |
Patil CG, Lad EM, Lad SP, et al. Visual loss after spine surgery: a population-based study[J]. Spine(Phila Pa 1976), 2008, 33(13): 1491-1496. DOI:10.1097/BRS.0b013e318175d1bf |
| [13] |
Goyal A, Elminawy M, Alvi MA, et al. Ischemic optic neuropathy following spine surgery: case control analysis and systematic review of the literature[J]. Spine(Phila Pa 1976), 2019, 44(15): 1087-1096. DOI:10.1097/BRS.0000000000003010 |
| [14] |
Pierce V, Kendrick P. Ischemic optic neuropathy after spine surgery[J]. AANA J, 2010, 78(2): 141-145. |
| [15] |
Quraishi NA, Wolinsky JP, Gokaslan ZL. Transient bilateral post-operative visual loss in spinal surgery[J]. Eur Spine J, 2012, 21(Suppl 4): S495-S498. |
| [16] |
朱天飞, 陈晓生, 张睿, 等. 颈椎术后视力丧失扭转临床报道一例[J]. 生物骨科材料与临床研究, 2019, 16(2): 79-80. |
| [17] |
Menzel-Severing J, Siekmann U, Weinberger A, et al. Early hyperbaric oxygen treatment for nonarteritic central retinal artery obstruction[J]. Am J Ophthalmol, 2012, 153(3): 454-459. DOI:10.1016/j.ajo.2011.08.009 |
| [18] |
Cugati S, Varma DD, Chen CS, et al. Treatment options for central retinal artery occlusion[J]. Curr Treat Options Neurol, 2013, 15(1): 63-77. DOI:10.1007/s11940-012-0202-9 |
| [19] |
Lee SH, Chung I, Choi DS, et al. Visual loss due to optic nerve infarction and central retinal artery occlusion after spine surgery in the prone position: a case report[J]. Medicine(Baltimore), 2017, 96(31): e7379. |
| [20] |
Kitaba A, Martin DP, Gopalakrishnan S, et al. Perioperative visual loss after nonocular surgery[J]. J Anesth, 2013, 27(6): 919-926. DOI:10.1007/s00540-013-1648-y |
 2021, Vol.19
2021, Vol.19  Issue(2): 141-144
Issue(2): 141-144


