腰背痛为常见病,50% ~ 80%的成年人在一生中出现过腰背痛症状,严重影响患者生活[1]。椎间盘退行性变(IDD)是导致椎间盘源性腰痛的重要原因之一。IDD是指在年龄增长过程中,椎间盘内的髓核组织水分逐渐减少,椎间盘失去正常的弹性和张力,在外界因素(如损伤,劳累等)的作用下,纤维环结构破坏,髓核组织结构发生异常改变。IDD是一个慢性炎性状态,发生退行性变的椎间盘中炎性因子显著升高,基质降解酶活性增高,血管神经长入发生退行性变的椎间盘[2]。更重要的是椎间盘基质中的炎性因子吸引炎性相关细胞进入发生退行性变的椎间盘,炎性细胞又刺激椎间盘细胞产生更多的促炎细胞因子,加速IDD的发展。
IDD是一个多因素的脊柱病理过程,同时在退行性变过程中发生复杂的结构和功能异常改变。细胞是生物体基本的结构和功能单位;椎间盘细胞的种类、数量、功能等与椎间盘的结构和功能密切相关。因此,在人体生长、发育和衰老过程中,椎间盘细胞的类型和病理生理变化对判断椎间盘结构和功能状态具有重要意义。本文分析了近年国内外关于IDD发展过程中其内部细胞类型变化及相关分子机制的研究,就椎间盘细胞特征及IDD过程中细胞的异常改变进行总结,包括IDD过程中椎间盘细胞种类、数量、功能、细胞密度、细胞增殖和衰老死亡等的改变,旨在为未来IDD的预防和治疗提供理论依据。
1 正常椎间盘细胞的组成与功能 1.1 脊索细胞脊索细胞在胎儿早期是常见细胞,但随着年龄增长,脊索细胞数量逐渐减少,衰老死亡的脊索细胞数量逐渐增多,4 ~ 10岁逐渐无法检测到,髓核内脊索细胞的凋亡提示IDD的开始[3]。脊索细胞具有较强的合成蛋白多糖的功能,而蛋白多糖具有与水结合的能力,所以脊索细胞可能负责维持髓核的凝胶状态[4]。Kim等[5]的研究表明,脊索细胞具有抗炎、抗凋亡和神经抑制作用。Aguiar等[6]认为,脊索细胞引导邻近的间充质细胞迁移至椎间盘,并分化生成髓核组织,最终形成椎间盘组织。成人髓核组织中脊索细胞的减少和消失可能与IDD的发生有关。
1.2 髓核细胞脊索细胞诱导间充质细胞向类髓核细胞定向分化,形成髓核细胞[7]。髓核细胞在形态和功能上与软骨细胞相似,组织切片上髓核细胞呈圆形或类圆形,位于陷窝中[8]。髓核细胞由中胚层的轴中胚层,即脊索,分化而来,属于纤维软骨细胞,而软骨细胞由中胚层的脊索旁中胚层的生骨节分化而来,属于透明软骨[9]。髓核细胞可以合成并分泌多种活性分子:Ⅱ型胶原蛋白和蛋白多糖等。髓核细胞所合成的基质成分极具亲水性,使髓核组织富含水分并极具黏弹性,因而能够有效吸收载荷,并能将载荷均匀分散到纤维环。
1.3 软骨细胞椎间盘的软骨终板是椎间盘主要的营养渗透途径之一。软骨终板主要由透明软骨细胞和细胞外基质构成,是维持脊柱生物力学稳定的关键结构。软骨终板细胞外基质具有保持软骨水分、维持组织张力和缓冲机械应力的作用[10]。生理范围内的流体静压可能是刺激椎间盘细胞合成基质的因素之一;过高或者过低的应力都可导致终板软骨细胞合成基质与基质降解失衡[11]。在异常应力作用下,终板软骨细胞发生损伤、死亡,使得细胞外基质平衡破坏,导致软骨终板营养弥散功能障碍,最终软骨终板发生钙化,被骨组织取代。软骨终板发生破裂、钙化进而引起椎间盘营养弥散通路障碍,直接导致椎间盘因营养供给不足而发生退行性变、钙化,甚至使代谢产物积聚于椎间盘内,激活椎间盘内的分解酶,导致基质破坏,细胞代谢障碍、死亡。
1.4 纤维环细胞纤维环是一种高度纤维化且排列有序的结构,可分为内层纤维环和外层纤维环。内层纤维环主要由圆形的纤维软骨细胞合成的Ⅱ型胶原组成,外层纤维环主要由细长的成纤维细胞合成的Ⅰ型胶原组成[12],这些纤维排列成复杂的结构以抵抗机械应力。有研究[13]报道,纤维环细胞来自Scx+Sox-9+祖细胞群体,外层细胞主要是细长纺锤样的成纤维样细胞;内层细胞与软骨细胞类似,也产生Ⅱ型胶原;层间基质有复杂的弹性纤维和桥接结构。纤维环外层存在一层表达CD146和转胶蛋白(SM22a)的细胞,这些CD146+的细胞可能是常驻干细胞,在伤口愈合和收缩中起重要作用[14]。随着年龄增长,干细胞的检测标志物逐渐降低,这可能与成人椎间盘损伤后修复能力降低相关[14]。纤维环细胞对纤维环结构的形成和维持具有重要意义。在IDD过程中,纤维环细胞逐渐衰老死亡,使纤维环结构破坏,进而加速IDD。
2 发生退行性变的椎间盘中细胞的组成与功能 2.1 血管内皮细胞正常状态下,椎间盘是无血管组织,通过邻近的椎体终板和周围纤维环的微血管扩散来接收营养物质和排出废物。但在IDD过程中,微血管形成并长入纤维环内层,甚至髓核组织。椎间盘营养供应异常被认为是引起IDD的主要原因[15]。髓核细胞的营养物质主要通过软骨终板内的微血管弥散至终板及髓核基质到达髓核细胞。Rodriguez等[16]的研究表明,终板硬化不是导致IDD的根本因素;通过对终板形态和终板退行性变之间的定量关系的研究发现,IDD过程中终板的微孔变得越来越多。Xu等[17]的研究表明,IDD过程中营养减少的原因不是终板钙化和硬化,而是终板微血管密度的降低。IDD过程中,血管内皮细胞逐渐凋亡,进而导致终板微血管密度降低[17]。髓核内所含有的蛋白多糖具有抑制血管长入的作用[18]。IDD时,髓核内聚蛋白多糖成分减少,促进血管长入的因素增多,导致新生血管长入并深达髓核,引起椎间盘源性腰痛,并且随着血管化程度增强,IDD程度也逐渐加重(图 1)。
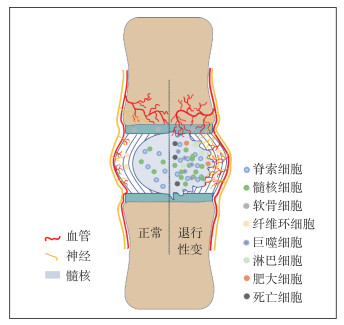
|
注:正常椎间盘组织中,神经、血管仅存在于纤维环外层,髓核中的细胞类型为脊索细胞、髓核细胞,纤维环中为纤维环细胞,软骨终板中为软骨细胞;发生退行性变的椎间盘组织中,神经、血管长入椎间盘内部组织,同时出现了巨噬细胞、淋巴细胞、肥大细胞等,细胞密度增大,衰老、死亡细胞数量增加。 图 1 正常椎间盘与发生退行性变的椎间盘对比 |
新生儿腰椎椎间盘终板和纤维环上有许多致密的神经纤维。随着年龄增长,这些神经纤维逐渐退化,仅剩下纤维环外部部分[19],正常成人腰椎椎间盘纤维环内侧区域不再存在神经结构[20](图 1)。Palmgren等[21]发现,在正常成人腰椎椎间盘外层纤维环中存在交感神经纤维标志物——神经肽Y,和感觉神经纤维标志物——P物质。提示椎间盘外层纤维有交感神经和脊神经支配。2003年,Fagan等[22]通过定量研究发现,正常椎间盘外层纤维环和终板间的神经密度分布无显著差异。椎间盘一旦发生病变,神经纤维在纤维环形成新的分布,病变部位的神经纤维分布密度增高[23]。有研究[24]发现,分布在椎间盘中的神经纤维来源于背根神经节的神经元。这些神经元可以根据细胞直径、神经递质类型和不同的细胞骨架成分进行分类。支配腰椎椎间盘的背根神经节神经元主要是小细胞神经元,这种小细胞神经元发出支配腰椎椎间盘的纤维[24]。而小细胞来源的神经纤维主要是损伤性神经纤维,这就构成了椎间盘源性腰背痛的解剖学基础。
IDD过程中神经纤维形成并进入纤维环内层和髓核是椎间盘源性腰背痛的主要神经机制。神经纤维可以沿着发生退行性变的椎间盘裂隙中的肉芽组织生长,这些神经纤维可逐渐深入到纤维环深部,甚至进入髓核[25](图 1)。IDD过程中产生的细胞因子是诱导神经末梢向发生退行性变的椎间盘生长的重要因素。例如,正常椎间盘髓核和纤维环细胞中存在少量神经生长因子和脑源性神经营养因子(BDNF),但椎间盘源性腰背痛患者发生退行性变的椎间盘中BDNF和神经生长因子的表达明显增加[26]。因此,IDD过程中可能会有神经纤维的长入,并且神经纤维末梢受到椎间盘内物质刺激后产生疼痛感觉。
2.3 巨噬细胞巨噬细胞表现出广泛的促炎、重塑和抗炎功能的动态表型谱,这些功能是急、慢性疾病的关键因素[27]。在对急性损伤的反应中,巨噬细胞在初期(0 ~ 3 d)迅速从促炎状态(M1表型)转变为随后(4~18d)抗炎状态(M2表型)[27]。M1表型巨噬细胞对启动血管生成至关重要[28]。M2表型巨噬细胞进一步细分为M2a和M2c表型,M2c表型具有重塑功能,因为其分泌大量基质金属蛋白酶-7(MMP-7),MMP-8,MMP-9[29]。尽管M2c表型巨噬细胞有助于组织修复[30],但这些细胞也与一些病理性退行性变疾病有关,如脊柱关节病、肌腱疾病、慢性静脉溃疡等。M2a表型与抗炎、促进愈合功能相关,但也和纤维化疾病相关,如肺纤维化、肾纤维化和腺体纤维化等。M1和M2c表型巨噬细胞随着IDD程度的加重而增多,在椎间盘的结构紊乱区域(髓核)尤其明显[27](图 1)。M1表型分泌高水平促炎因子,如TNF-α和IL-1β;M2c表型产生较高水平的MMP,而MMP与细胞外基质重塑相关;抗炎的M2a表型与组织修复的最后阶段相关[28]。在体实验[31]表明,髓核组织暴露于纤维环和背根神经节会招募更多的巨噬细胞。椎间盘严重退行性变区域出现大量含有巨噬细胞表型标志物的细胞,表明巨噬细胞在IDD损伤和愈合过程中发挥重要作用。巨噬细胞在椎间盘损伤修复不同阶段中表现出的不同表型有利于维持椎间盘结构和功能的稳定。
2.4 T淋巴细胞正常成人椎间盘内没有T淋巴细胞,但发生退行性变的椎间盘中能检测出T淋巴细胞[32]。胚胎发育成熟后,外层纤维环将椎间盘组织与血液循环隔离,从而形成了椎间盘自身免疫的基础。纤维环同心层由交替排列的倾斜胶原纤维和蛋白多糖构成,软骨终板含有蛋白多糖和胶原蛋白,高浓度蛋白多糖结构抑制了血管生长,因此,纤维环和软骨终板及免疫调节相关分子可视为血液-髓核屏障,该屏障将髓核与人体的免疫系统分隔开来[33]。IDD过程中,纤维环或终板的破坏使此屏障被打破,导致血管以机械或化学诱导的形式逐渐长入,髓核的免疫反应会引发各种下游级联反应,进而引起髓核脱出、神经受压导致的下肢疼痛等一系列改变。髓核组织接触循环系统的内皮细胞成分后,髓核内T淋巴细胞增加[34](图 1)。IDD早期,T细胞活化,细胞毒性T细胞改变椎间盘内细胞溶酶体膜通透性,进而释放溶酶体酶,损伤细胞和细胞外基质[35]。T细胞在椎间盘的聚集可能与IDD形成恶性循环,从而加速IDD发展。
2.5 肥大细胞正常椎间盘内无肥大细胞存在,但长入椎间盘的肉芽组织中可检测到较多肥大细胞[36](图 1)。肥大细胞在发生退行性变的椎间盘中脱颗粒,进而促进炎性反应、血管生成和疼痛;肥大细胞还可激活成纤维细胞并使其增殖,在组织纤维化过程中起作用[37]。肥大细胞可以产生神经生长因子诱导神经长入椎间盘的内层,从而导致椎间盘源性腰痛[38]。肥大细胞通过成纤维细胞刺激胶原酶形成,胶原酶增多可破坏椎间盘细胞外基质及胶原组织,使髓核中蛋白多糖减少及纤维中胶原强度降低[39],最终加速IDD发展。
3 IDD过程中细胞的变化 3.1 细胞类型不同类型的细胞分布在椎间盘的不同区域,软骨终板细胞主要由圆形软骨细胞组成,外层纤维环细胞呈长条形或成纤维细胞样,纤维环最内层和髓核内的细胞则呈球形或软骨细胞样。在IDD过程中,软骨终板和纤维环的细胞类型基本不发生变化,髓核内细胞类型发生巨大变化[40-41]。正常椎间盘中,髓核中的细胞类型为脊索细胞、髓核细胞,纤维环中为纤维环细胞,软骨终板中为软骨细胞;发生退行性变的椎间盘组织中,同时出现了巨噬细胞、淋巴细胞、肥大细胞等。
3.2 细胞数量在IDD过程中,椎间盘内活细胞数量减少、密度降低,椎间盘细胞数量的变化是波动的而不是线性的。有研究[42]发现,随着年龄增长,椎间盘细胞密度显著降低,并伴有水分减少等早期IDD特征。在经过早期的椎间盘细胞数量短暂减少后,椎间盘细胞密度逐渐增加。Ishii等[43]也发现,随着内层纤维环退行性变程度的加重,细胞密度相应增加。Hastreiter等[44]也认为,在内层纤维环和髓核中,Ⅴ级退行性变的椎间盘细胞密度高于退行性变程度更轻的椎间盘。但以上报道未深入研究增加的细胞的活力。由于在光镜下死细胞与活细胞相似,所以在IDD过程中,髓核和纤维环中活细胞数量总体是降低的。
3.3 衰老死亡细胞数量髓核和纤维环内层的细胞营养主要依赖软骨终板的营养弥散。几乎所有软骨终板的血管在儿童时期消失,并且终板厚度随着年龄增长而逐渐变薄,这些改变都会影响椎间盘的营养供应及椎间盘细胞的活力。在动物模型中可以观察到,异常的应力会导致IDD和椎间盘细胞死亡。IDD进程中,椎间盘内衰老死亡细胞数量呈持续增长状态[45](图 1)。衰老死亡的细胞释放出炎性因子,促进椎间盘局部的炎性反应,这可能是加速IDD发生发展的因素之一。
3.4 细胞增殖许多研究表明,IDD过程中软骨细胞的增殖活性增强。Miyamoto等[46]的研究发现,小鼠颈椎病模型中,颈椎椎间盘有不同程度的软骨组织增生。Johnson等[47]发现,细胞增殖常出现在发生退行性变的椎间盘中,特别是在细胞簇聚集区域。在人腰椎IDD过程中,软骨细胞数量和大小均增加,所以部分研究者将细胞增殖作为IDD的指标之一。虽然发生退行性变的椎间盘中总的营养供应是减少的,但由于神经和血管的长入,使椎间盘内局部营养相对增加,因此,新生血管的长入可能是发生退行性变的椎间盘中出现局部细胞增殖的原因之一。
3.5 细胞衰老椎间盘细胞的衰老可能是IDD发生的原因之一。细胞停止分化后就会开始衰老,主要有2种机制,一种是细胞反复分裂导致细胞染色体端粒缩短而引起的细胞衰老[48],椎间盘细胞分裂次数越多就越接近衰老状态;另一种是应激损伤DNA分子导致的细胞衰老,应激因素包括活性氧、机械负荷、细胞因子等。有研究[49]表明,与衰老相关的β-半乳糖苷酶在突出椎间盘的髓核成簇细胞中,随着IDD程度的增加,β-半乳糖苷酶表达也逐渐增加。
3.6 细胞表型细胞表型改变包括形态、代谢、对环境的反应、基因表达等方面。衰老的椎间盘细胞通常会发生细胞表型的改变,其中一部分表型的改变可能是可逆的,如在人发生退行性变的椎间盘细胞中Ⅱ型和Ⅹ型胶原蛋白基因表达明显下降,但在三维环境下重新培养时,这些基因均重新表达;不可逆的表型改变包括细胞坏死、凋亡等。在IDD过程中,椎间盘细胞合成髓核基质成分的能力下降,分解代谢增强,生长因子和炎性因子等的分泌发生改变。在IDD过程中,椎间盘细胞会发生形态变化。据报道,正常情况下椎间盘细胞为梭形,但在IDD过程中,纤维环细胞逐渐变为圆形,形态类似于软骨细胞[50]。机械应力负荷是导致椎间盘细胞表型改变的重要因素之一。生理水平的机械应力促进椎间盘细胞中蛋白多糖和金属蛋白酶组织抑制因子-1(TIMP-1)的产生,然而过高或过低的应力则导致蛋白多糖和TIMP-1合成降低[51]。异常的机械应力也会导致椎间盘细胞产生促炎细胞因子。不平衡的应力加速大鼠IDD,增强IL-1β的产生[52]。纤维环在正常椎间盘中承受张力呈梭形,而在发生退行性变的椎间盘中承受更多的压力呈圆形,这与肌腱中的细胞承受张力呈梭形,关节软骨中的细胞承受压力呈圆形原理一致。
4 结语与展望综上,椎间盘细胞在IDD过程中细胞会发生类型改变、密度改变、增殖、衰老、死亡和表型改变等多种变化,其中数量减少和表型改变是最重要的变化。细胞的异常变化常伴随着异常细胞因子(促炎因子、趋化因子、细胞衰老凋亡相关因子等)的产生,这些异常改变可以作用于邻近的正常椎间盘细胞并使之衰老、凋亡,进而导致椎间盘结构和功能变化,使椎间盘在一般强度的体内、外环境因素的作用下即发生损伤,因而形成IDD的恶性循环。另外,椎间盘中细胞外基质合成与降解的平衡对于椎间盘结构与功能的维持至关重要。在IDD过程中,促进细胞外基质合成的因素(如转化生长因子)与促进降解的因素(如MMP)失衡,使细胞外基质中的胶原和蛋白多糖的降解增加,引起椎间盘内部缓冲机械应力的能力降低,导致椎间盘细胞损伤和炎性反应,加速细胞衰老、凋亡,从而使椎间盘更易遭到机械力的破坏。IDD是遗传因素与环境因素共同造成的,不同的因素对椎间盘损伤的分子机制也可能有较大差异,深入研究IDD的细胞分子机制对于其预防和治疗具有十分重要的意义。
| [1] |
Fatoye F, Gebrye T, Odeyemi I. Real-world incidence and prevalence of low back pain using routinely collected data[J]. Rheumatol Int, 2019, 39(4): 619-626. DOI:10.1007/s00296-019-04273-0 |
| [2] |
Cornejo MC, Cho SK, Giannarelli C, et al. Soluble factors from the notochordal-rich intervertebral disc inhibit endothelial cell invasion and vessel formation in the presence and absence of pro-inflammatory cytokines[J]. Osteoarthritis Cartilage, 2015, 23(3): 487-496. DOI:10.1016/j.joca.2014.12.010 |
| [3] |
赵献峰, 刘浩, 丰干均, 等. 脊索细胞促进髓核软骨样细胞增殖及表型维持[J]. 中国修复重建外科杂志, 2008, 22(8): 939-943. |
| [4] |
Rajasekaran S, Tangavel C, Djuric N, et al. Part 1:profiling extra cellular matrix core proteome of human fetal nucleus pulposus in search for regenerative targets[J]. Sci Rep, 2020, 10(1): 15684. DOI:10.1038/s41598-020-72859-x |
| [5] |
Kim KW, Ha KY, Lee JS, et al. The apoptotic effects of oxidative stress and antiapoptotic effects of caspase inhibitors on rat notochordal cells[J]. Spine(Phila Pa 1976), 2007, 32(22): 2443-2448. DOI:10.1097/BRS.0b013e318157395a |
| [6] |
Aguiar DJ, Johnson SL, Oegema TR. Notochordal cells interact with nucleus pulposus cells: regulation of proteoglycan synthesis[J]. Exp Cell Res, 1999, 246(1): 129-137. DOI:10.1006/excr.1998.4287 |
| [7] |
Hayes AJ, Ralphs JR. The response of foetal annulus fibrosus cells to growth factors: modulation of matrix synthesis by TGF-β1 and IGF-1[J]. Histochem Cell Biol, 2011, 136(2): 163-175. DOI:10.1007/s00418-011-0835-x |
| [8] |
刘小云, 杨述华, 熊涛, 等. 人椎间盘髓核细胞突起的形态学特征[J]. 解剖学报, 2007, 38(4): 466-469. DOI:10.3321/j.issn:0529-1356.2007.04.018 |
| [9] |
李海音, 李长青. 成人髓核细胞特征性表达基因的筛选与验证[J]. 第三军医大学学报, 2014, 36(10): 1036-1039. |
| [10] |
Sivan SS, Hayes AJ, Wachtel E, et al. Biochemical composition and turnover of the extracellular matrix of the normal and degenerate intervertebral disc[J]. Eur Spine J, 2014, 23(Suppl 3): S344-S353. |
| [11] |
Wang Y, Yi XD, Li CD. The influence of artificial nucleus pulposus replacement on stress distribution in the cartilaginous endplate in a 3-dimensional finite element model of the lumbar intervertebral disc[J]. Medicine(Baltimore), 2017, 96(50): e9149. |
| [12] |
Chelberg MK, Banks GM, Geiger DF, et al. Identification of heterogeneous cell populations in normal human intervertebral disc[J]. J Anat, 1995, 186(Pt 1): 43-53. |
| [13] |
Sugimoto Y, Takimoto A, Akiyama H, et al. Scx+/Sox9+ progenitors contribute to the establishment of the junction between cartilage and tendon/ligament[J]. Development, 2013, 140(11): 2280-2288. DOI:10.1242/dev.096354 |
| [14] |
Nakai T, Sakai D, Nakamura Y, et al. CD146 defines commitment of cultured annulus fibrosus cells to express a contractile phenotype[J]. J Orthop Res, 2016, 34(8): 1361-1372. DOI:10.1002/jor.23326 |
| [15] |
薄冉, 杨庆国, 段文, 等. 软骨终板形态与椎间盘退变的相关性[J]. 中国组织工程研究, 2012, 16(24): 4413-4416. DOI:10.3969/j.issn.1673-8225.2012.24.009 |
| [16] |
Rodriguez AG, Rodriguez-Soto AE, Burghardt AJ, et al. Morphology of the human vertebral endplate[J]. J Orthop Res, 2012, 30(2): 280-287. DOI:10.1002/jor.21513 |
| [17] |
Xu HM, Hu F, Wang XY, et al. Relationship between apoptosis of endplate microvasculature and degeneration of the intervertebral disk[J]. World Neurosurg, 2019, 125: e392-e397. DOI:10.1016/j.wneu.2019.01.085 |
| [18] |
Beckett MC, Ralphs JR, Caterson B, et al. The transmembrane heparan sulphate proteoglycan syndecan-4 is involved in establishment of the lamellar structure of the annulus fibrosus of the intervertebral disc[J]. Eur Cell Mater, 2015, 30: 69-88. DOI:10.22203/eCM.v030a06 |
| [19] |
Roberts S, Evans EH, Kletsas D, et al. Senescence in human intervertebral discs[J]. Eur Spine J, 2006, 15(Suppl 3): S312-S316. |
| [20] |
Bogduk N, Tynan W, Wilson AS. The nerve supply to the human lumbar intervertebral discs[J]. J Anat, 1981, 132(Pt 1): 39-56. |
| [21] |
Palmgren T, Grönblad M, Virri J, et al. An immunohistochemical study of nerve structures in the anulus fibrosus of human normal lumbar intervertebral discs[J]. Spine(Phila Pa 1976), 1999, 24(20): 2075-2079. DOI:10.1097/00007632-199910150-00002 |
| [22] |
Fagan A, Moore R, Vernon Roberts B, et al. ISSLS prize winner: the innervation of the intervertebral disc: a quantitative analysis[J]. Spine(Phila Pa 1976), 2003, 28(23): 2570-2576. DOI:10.1097/01.BRS.0000096942.29660.B1 |
| [23] |
Jiang H, Wang J, Xu B, et al. Study on the expression of nerve growth associated protein-43 in rat model of intervertebral disc degeneration[J]. J Musculoskelet Neuronal Interact, 2017, 17(2): 104-107. |
| [24] |
Takahashi Y, Ohtori S, Takahashi K. Peripheral nerve pathways of afferent fibers innervating the lumbar spine in rats[J]. J Pain, 2009, 10(4): 416-425. DOI:10.1016/j.jpain.2008.10.012 |
| [25] |
Henry SP, Liang S, Akdemir KC, et al. The postnatal role of Sox9 in cartilage[J]. J Bone Miner Res, 2012, 27(12): 2511-2525. DOI:10.1002/jbmr.1696 |
| [26] |
Krock E, Rosenzweig DH, Chabot-Doré AJ, et al. Painful, degenerating intervertebral discs up-regulate neurite sprouting and CGRP through nociceptive factors[J]. J Cell Mol Med, 2014, 18(6): 1213-1225. DOI:10.1111/jcmm.12268 |
| [27] |
Nakazawa KR, Walter BA, Laudier DM, et al. Accumulation and localization of macrophage phenotypes with human intervertebral disc degeneration[J]. Spine J, 2018, 18(2): 343-356. DOI:10.1016/j.spinee.2017.09.018 |
| [28] |
Spiller KL, Nassiri S, Witherel CE, et al. Sequential delivery of immunomodulatory cytokines to facilitate the M1-to-M2 transition of macrophages and enhance vascularization of bone scaffolds[J]. Biomaterials, 2015, 37: 194-207. DOI:10.1016/j.biomaterials.2014.10.017 |
| [29] |
Lurier EB, Dalton D, Dampier W, et al. Transcriptome analysis of IL-10-stimulated(M2c) macrophages by next-generation sequencing[J]. Immunobiology, 2017, 222(7): 847-856. DOI:10.1016/j.imbio.2017.02.006 |
| [30] |
Evans BJ, Haskard DO, Sempowksi G, et al. Evolution of the macrophage CD163 phenotype and cytokine profiles in a human model of resolving inflammation[J]. Int J Inflam, 2013, 2013: 780502. |
| [31] |
You C, Zhu K, Liu X, et al. Tumor necrosis factor-α-dependent infiltration of macrophages into the dorsal root ganglion in a rat disc herniation model[J]. Spine(Phila Pa 1976), 2013, 38(23): 2003-2007. DOI:10.1097/BRS.0b013e3182a84701 |
| [32] |
Gorth DJ, Shapiro IM, Risbud MV. Transgenic mice overexpressing human TNF-α experience early onset spontaneous intervertebral disc herniation in the absence of overt degeneration[J]. Cell Death Dis, 2018, 10(1): 7. |
| [33] |
Johnson WE, Caterson B, Eisenstein SM, et al. Human intervertebral disc aggrecan inhibits endothelial cell adhesion and cell migration in vitro[J]. Spine(Phila Pa 1976), 2005, 30(10): 1139-1147. DOI:10.1097/01.brs.0000162624.95262.73 |
| [34] |
张海平, 张烽, 姚羽. 腰椎间盘突出髓核的自身免疫性[J]. 中国组织工程研究, 2012, 16(48): 8931-8937. DOI:10.3969/j.issn.2095-4344.2012.48.001 |
| [35] |
Zhou HY, Li Q, Wang JX, et al. Low-intensity pulsed ultrasound repair in mandibular condylar cartilage injury rabbit model[J]. Arch Oral Biol, 2019, 104: 60-66. DOI:10.1016/j.archoralbio.2019.05.018 |
| [36] |
Wiet MG, Piscioneri A, Khan SN, et al. Mast cell-intervertebral disc cell interactions regulate inflammation, catabolism and angiogenesis in Discogenic Back Pain[J]. Sci Rep, 2017, 7(1): 12492. DOI:10.1038/s41598-017-12666-z |
| [37] |
Freemont AJ, Jeziorska M, Hoyland JA, et al. Mast cells in the pathogenesis of chronic back pain: a hypothesis[J]. J Pathol, 2002, 197(3): 281-285. DOI:10.1002/path.1107 |
| [38] |
Freemont AJ, Watkins A, Le Maitre C, et al. Nerve growth factor expression and innervation of the painful intervertebral disc[J]. J Pathol, 2002, 197(3): 286-292. DOI:10.1002/path.1108 |
| [39] |
Malone DG, Irani AM, Schwartz LB, et al. Mast cell numbers and histamine levels in synovial fluids from patients with diverse arthritides[J]. Arthritis Rheum, 1986, 29(8): 956-963. DOI:10.1002/art.1780290803 |
| [40] |
李朝顶. 脊索细胞与椎间盘退变的相关性研究[D]. 苏州: 苏州大学, 2010.
|
| [41] |
Bruehlmann SB, Rattner JB, Matyas JR, et al. Regional variations in the cellular matrix of the annulus fibrosus of the intervertebral disc[J]. J Anat, 2002, 201(2): 159-171. DOI:10.1046/j.1469-7580.2002.00080.x |
| [42] |
Zhao H, Ni CF, Huang J, et al. Effects of bone cement on intervertebral disc degeneration[J]. Exp Ther Med, 2014, 7(4): 963-969. DOI:10.3892/etm.2014.1531 |
| [43] |
Ishii T, Tsuji H, Sano A, et al. Histochemical and ultrastructural observations on brown degeneration of human intervertebral disc[J]. J Orthop Res, 1991, 9(1): 78-90. DOI:10.1002/jor.1100090111 |
| [44] |
Hastreiter D, Ozuna RM, Spector M. Regional variations in certain cellular characteristics in human lumbar intervertebral discs, including the presence of alpha-smooth muscle actin[J]. J Orthop Res, 2001, 19(4): 597-604. DOI:10.1016/S0736-0266(00)00069-3 |
| [45] |
Gruber HE, Hanley EN Jr. Analysis of aging and degeneration of the human intervertebral disc. Comparison of surgical specimens with normal controls[J]. Spine(Phila Pa 1976), 1998, 23(7): 751-757. DOI:10.1097/00007632-199804010-00001 |
| [46] |
Miyamoto S, Yonenobu K, Ono K. Experimental cervical spondylosis in the mouse[J]. Spine(Phila Pa 1976), 1991, 16(10 Suppl): S495-S500. |
| [47] |
Johnson WE, Eisenstein SM, Roberts S. Cell cluster formation in degenerate lumbar intervertebral discs is associated with increased disc cell proliferation[J]. Connect Tissue Res, 2001, 42(3): 197-207. DOI:10.3109/03008200109005650 |
| [48] |
Wu J, Crowe DL. Telomere DNA damage signaling regulates prostate cancer tumorigenesis[J]. Mol Cancer Res, 2020, 18(9): 1326-1339. DOI:10.1158/1541-7786.MCR-19-1129 |
| [49] |
Huang H, Cheng S, Zheng T, et al. Vitamin D retards intervertebral disc degeneration through inactivation of the NF-κB pathway in mice[J]. Am J Transl Res, 2019, 11(4): 2496-2506. |
| [50] |
Miyamoto T, Muneta T, Tabuchi T, et al. Intradiscal transplantation of synovial mesenchymal stem cells prevents intervertebral disc degeneration through suppression of matrix metalloproteinase-related genes in nucleus pulposus cells in rabbits[J]. Arthritis Res Ther, 2010, 12(6): R206. DOI:10.1186/ar3182 |
| [51] |
Feng C, Yang M, Zhang Y, et al. Cyclic mechanical tension reinforces DNA damage and activates the p53-p21-Rb pathway to induce premature senescence of nucleus pulposus cells[J]. Int J Mol Med, 2018, 41(6): 3316-3326. |
| [52] |
Lin J, Chen J, Zhang Z, et al. Luteoloside inhibits IL-1β-induced apoptosis and catabolism in nucleus pulposus cells and ameliorates intervertebral disk degeneration[J]. Front Pharmacol, 2019, 10: 868. DOI:10.3389/fphar.2019.00868 |
 2021, Vol.19
2021, Vol.19  Issue(5): 347-352
Issue(5): 347-352


