2. 解放军总医院第一医学中心骨科,北京 100853
2. Department of Orthopaedics, Fist Medical Center of Chinese PLA General Hospital, Beijing 100853, China
经皮椎体成形术(PVP)治疗老年骨质疏松性椎体压缩性骨折(OVCF)已广泛应用于临床,并取得了令人满意的效果[1]。但是,随着该项技术的开展,许多因骨水泥分布不均导致的并发症也随之产生,如再骨折、邻近椎体骨折甚至脊柱侧凸等[2-3]。因此,如何改进技术,使骨水泥在椎体内平衡分布,是目前的研究热点之一。濮阳市油田总医院2016年1月—2018年1月采用弯角经皮椎体成形术(PCVP)和PVP治疗OVCF患者175例,本研究通过分析术中骨水泥用量及术后分布状态,为临床工作提供参考,现报告如下。
1 资料与方法 1.1 一般资料纳入标准[4]:①无/轻微外伤史;②6周内发生的急性症状性骨折;③术前可俯卧超过30 min,可耐受局部麻醉;④MRI检查示单节段压缩性骨折;⑤双能X线(DXA)检查示骨密度T值≤-2.5。排除标准[4]:①伴脊髓、马尾神经、神经根损伤症状或体征;②伴骨折脱位、弥漫性特发性骨肥厚(DISH)、病理性骨折、强直性脊柱炎骨折;③未成年。根据上述标准,纳入OVCF患者175例(骨折节段为T8~L5),其中85例采用PCVP治疗(A组)、90例采用PVP治疗(B组)。根据骨折节段,A组分为A1亚组(T8~12,55例)和A2亚组(L1~5,30例);B组分为B1亚组(T8~12,58例)和B2亚组(L1~5,32例)。A组采用SV100-01骨水泥填充器套件(华科润生物科技有限公司,宁波),组件包含SV120-01骨水泥搅拌套装、SV130弯角输送导管、SV150定位板;B组采用常规器械。2组均使用聚甲基丙烯酸甲酯骨水泥(PEEK,贺利氏公司,德国)。2组患者术前一般资料差异无统计学意义(P > 0.05,表 1),具有可比性。入院后与患者及家属沟通,自愿选择手术方式并签署知情同意书,手术均由同一组医师完成。
|
|
表 1 2组患者一般资料 |
2组术前30 min常规注射阿片类镇痛药物,全程数字减影血管造影(DSA)X线机引导下操作,所用骨水泥使用前冷藏24 h。患者均采取俯卧位,腹部悬空,维持过伸体位,适度体外按压复位,透视定位伤椎并观察复位情况,常规消毒,铺无菌单,1%利多卡因局部麻醉。
A组均采用单侧椎弓根穿刺,穿刺针经椎弓根入路进入椎体,侧位透视确认穿刺针达椎体后1/4时拔出内芯。逐步置入弯角椎体成形穿刺装置,正位透视其前缘到达椎体对侧椎弓根内壁,侧位透视位于椎体前1/3,拔出镍钛合金导芯。搅拌骨水泥,使用推进泵通过弯角骨水泥注射器在对侧1/3椎体注入部分骨水泥,然后依据器械设计,将骨水泥注射器退出1格(1 cm),在椎体中部1/3缓慢注入骨水泥,同法在穿刺侧1/3椎体注入骨水泥,直至注射器退至安全线。骨水泥注射完毕,正侧位透视无误,拔出工作通道,包扎,术毕。
B1组采用单侧椎弓根穿刺,B2组采用双侧椎弓根穿刺。穿刺针经椎弓根内倾下进入椎体,正位透视到达椎弓根影内壁,侧位透视越过椎体后缘,拔出内芯,置入导针,沿导针放入工作套管。精细钻达椎体前中1/3交界处,取出精细钻。骨水泥凝固早期使用推进泵注入少量骨水泥,透视见骨水泥在椎体内弥散,骨水泥成“牙膏状”后再次在透视下注入部分骨水泥。骨水泥注射完毕,正侧位透视无误,拔出工作通道,包扎,术毕。
术中如骨水泥有渗漏趋势且正位透视显示分布不均,A组可尝试退格“换点”后继续注射至分布均匀;若渗漏趋势继续加重,停止注射。B组应等待骨水泥凝固后尝试再次注射,若渗漏趋势加重则停止注射,单侧穿刺患者在骨水泥无渗漏前提下应尽量保证骨水泥过椎体中线。
患者术后卧床24 h,常规使用1次抗生素预防感染,可翻身活动,术后1 d可佩戴腰围下床活动,同时给予抗骨质疏松治疗,并指导其进行腰背肌功能锻炼。术后定期复查正侧位X线片。
1.3 观察指标在正位X线片上用中央垂线(棘突线)、双侧椎弓根内缘垂线将椎体分为1~4区(图 1),将骨水泥分布情况分为5个类型[3]:Ⅰ型,大部分骨水泥连续、均匀分布在1~4区;Ⅱ型,大部分骨水泥分布在2~3区;Ⅲ型,大部分骨水泥分布在1区和4区;Ⅳ型,大部分骨水泥分布在1~2区或3~4区;Ⅴ型,大部分骨水泥分布在1区或4区。其中,Ⅳ型和Ⅴ型判定为骨水泥分布不均。依据上述分型评价各组患者术后骨水泥分布情况。记录各组骨水泥注入量,采用疼痛视觉模拟量表(VAS)评分[4]评估手术前后疼痛程度,并记录随访时间内同一椎体及邻近椎体再骨折情况。所有数据均由不参与手术的专科医师进行评估及测算。
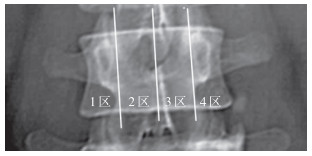
|
图 1 骨水泥分布分区示意图 |
采用SPSS 19.0软件对数据进行统计分析,计量资料以x±s表示,组间比较采用独立样本t检验;计数资料以例数(%)表示,采用CMH-χ2检验;以P < 0.05为差异有统计学意义。
2 结果所有患者顺利完成手术,随访6~24(11.7±1.5)个月,均未发生骨水泥椎旁渗漏、椎管内渗漏、肺动脉栓塞等并发症。各组术后VAS评分均较术前明显改善,差异有统计学意义(P < 0.05,表 2)。B2组骨水泥注入量明显高于A2组,差异有统计学意义(P < 0.05,表 2)。B1组骨水泥分布不均比例明显高于A1组,差异有统计学意义(P < 0.05,表 2)。
|
|
表 2 各组观察指标 |
末次随访时,A1、A2组未发生同一椎体再骨折,各发生2例邻近椎体骨折;B1组发生1例同一椎体再骨折,6例邻近椎体骨折,B2组发生1例邻近椎体骨折。A1与B1组邻近椎体再骨折率相比,差异有统计学意义(P < 0.05);A2与B2组相比,差异无统计学意义(P > 0.05)。A组典型病例影像学资料见图 2。
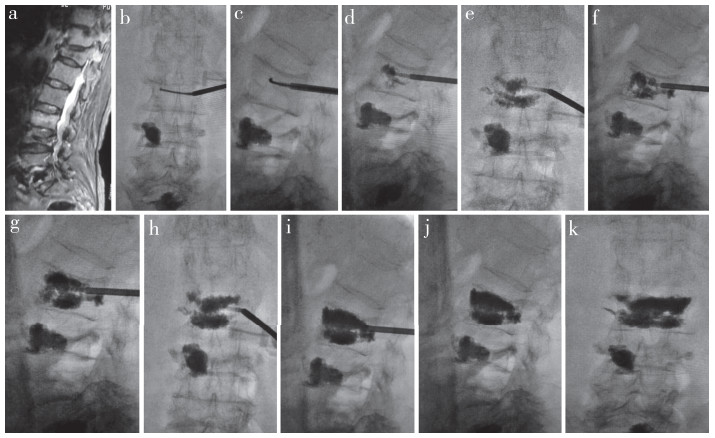
|
图 2 A组典型病例影像学资料 女,72岁,因“腰背部疼痛10余天”入院,诊断为L2 OVCF,曾因OVCF多次接受PVP治疗(T11、L3、L5),本次骨折发生在邻近椎体L2 a:术前MRI示L2 OVCF b~c:术中置入弯角穿刺装置 d:对侧注入骨水泥 e~f:退格后继续注入,透视可见少量骨水泥椎体旁渗漏(正位),且向后方弥散趋势(侧位) g~h:退格后继续注入,透视可见椎旁渗漏未加重,后方弥散加重趋势不明显,骨水泥分布不均(Ⅳ型) i~k:退格至穿刺侧继续注入,透视可见椎旁渗漏及后方弥散均未加重,骨水泥分布均匀(Ⅰ型),骨水泥注入量约为5.0 mL |
OVCF现已逐渐成为人们关注的严重社会健康问题,椎体强化术是增加椎体力学强度并缓解疼痛的有效手段。本研究结果也显示所有患者术后短期内腰背部疼痛较术前均明显改善。但随着该项技术的开展,越来越多的研究[5-6]证实,其远期手术效果与骨水泥用量不呈正相关,而与骨水泥分布形态密切相关。骨水泥注入后会导致骨折椎体刚度和强度发生改变,一旦骨水泥在椎体内分布不均,易导致再骨折、邻近椎体骨折等并发症[7]。本研究组前期研究[3]结果显示,大部分骨水泥在椎体内呈连续、均匀分布并少量向椎体上、下终板逐渐弥散是最理想的骨水泥分布形态,而骨水泥分布不均是导致邻近椎体骨折和同一椎体再骨折的主要因素,其中,Ⅴ型分布的患者邻近椎体骨折的发生率为18%。本研究中,B1组69%的患者骨水泥分布不均,随访中共6例发生邻近椎体骨折,其中3例发生在Ⅴ型分布椎体的邻近椎体;1例发生同一椎体再骨折为Ⅴ型分布椎体,其发生率明显高于其他组。
传统PVP是依靠骨水泥单点弥散,而“单点”的注入方式想要达到骨水泥均匀分布,需要增加骨水泥用量,靠挤压力量使骨水泥弥散至对侧,这样会不断增加局部压力,使骨水泥沿骨折线或骨小梁弥散,甚至渗漏至椎体旁或静脉[8-10]。一旦发现渗漏迹象,唯一方法就是停止注入,即导致骨水泥分布不均。同时,随着骨水泥缓慢注入,单点注入势必导致局部骨水泥黏度变大,对随后注入的骨水泥的弥散产生一定阻力,从而影响骨水泥整体弥散程度,无法达到早期弥散效果。本研究中B1组出现15例Ⅴ型分布,均是在注入早期即出现渗漏迹象或已发生渗漏,导致无法继续注入,致使骨水泥分布严重不均。此外,本研究组前期研究[11]还通过极外侧入路进入椎体中央甚至对侧,然后进行骨水泥注入,但这种穿刺方式是否会增加脏器损伤风险、发生骨水泥渗漏后是否可继续注入等问题仍有待研究。传统的双侧穿刺PVP能获得较对称的骨水泥填充,本研究中B2组均为双侧穿刺,骨水泥分布不均比例仅为3.1%,也证实了双侧穿刺的优势。但是,手术时间延长、透视时间增多、临床费用增加、过量骨水泥的毒素作用、穿刺损伤脏器及骨水泥渗漏等风险增加,使临床医师更愿意选择单侧穿刺。因此,如何单侧穿刺用适量骨水泥获得更好的骨水泥分布,是PVP技术新的挑战。
PCVP保留了PVP的优点[12],同时很好地解决了上述问题,其利用镍钛合金的超高弹性特性和PEEK较好的机械强度特点,将弯管骨水泥输送鞘(即骨水泥注入器)通过单侧穿刺延伸到对侧椎弓根与椎体前1/3交点处,对对侧、中央及穿刺侧椎体进行多点、多次、少量注入骨水泥,既保证骨水泥弥散效果,也避免了靠“量”弥散的缺点,同时减少了穿刺引起的损伤及透视次数,保证了骨水泥在椎体内的均匀分布。本研究中A组患者均采用PCVP治疗,A1、B1组骨水泥用量差异无统计学意义,但A1组术后骨水泥分布形态明显优于B1组;A2、B2组骨水泥分布不均比例差异无统计学意义,但A2组骨水泥用量明显少于B2组,证明了PCVP可以用相对少量的骨水泥获得更佳的椎体内分布效果。另外,PCVP通过多点、多次注入,将“单点”注射压力分布为“多点”,提高了骨水泥弥散程度,同时减少了渗漏发生率;而且即使发生渗漏,仍可“换点”继续注入。A组22例术中发现骨水泥渗漏,随即停止在该点注射,“换点”后继续注入骨水泥,从而获得骨水泥均匀分布,所有患者未发生骨水泥渗漏。
本研究组的PCVP临床使用经验如下。①术前通过CT观察骨折区,术中自骨折较重侧穿刺进针,无须过度内倾,通过弯角穿刺针到达对侧,这样会减少骨水泥凝固早期渗漏发生率。②若为终板下骨折,应尽量使注射通道位于骨折区下方,因为弯角通道的骨水泥出口位于下方,依靠骨水泥在正常骨质中的弥散效果覆盖骨折区,从而减少其沿骨折线渗漏的可能。③持续DSA监测,在骨水泥凝固早期即少量注入,若观察到渗漏迹象,可在该点停止注入,通过骨水泥注射器“退格”“换点”后继续注入,以达到骨水泥均匀分布的目的。
椎体再骨折有诸多影响因素,如生物学因素,包括年龄、体质量指数、骨密度T值、抗骨质疏松药物使用等,以及手术操作引起的其他生物力学改变,包括骨水泥注入量、术后椎体后凸程度、骨水泥是否渗漏入椎间盘等。未能排除上述干扰因素、且缺少生物力学研究的支持是本研究的局限,但是,骨水泥分布不均应作为椎体再骨折的主要因素来分析。PCVP具备“多次”“多点”注入骨水泥的优点,可用相对少量的骨水泥获得更好的骨水泥分布效果,且减少了手术操作导致的椎体再骨折、侧凸等远期并发症发生率。
| [1] |
Bousson V, Hamze B, Odri G, et al. Percutaneous vertebral augmentation techniques in osteoporotic and traumatic fractures[J]. Semin Intervent Radiol, 2018, 35(4): 309-323. DOI:10.1055/s-0038-1673639 |
| [2] |
Martinez-Ferrer A, Blasco J, Carrasco JL, et al. Risk factors for the development of vertebral fractures after percutaneous vertebroplasty[J]. J Bone Mineral Res, 2013, 28(8): 1821-1829. DOI:10.1002/jbmr.1899 |
| [3] |
张大鹏, 毛克亚, 强晓军, 等. 椎体增强术后骨水泥分布形态分型及其临床意义[J]. 中华创伤杂志, 2018, 34(2): 130-137. DOI:10.3760/cma.j.issn.1001-8050.2018.02.007 |
| [4] |
Huskisson EC. Measurement of pain[J]. Lancet, 1974, 2(7889): 1127-1131. |
| [5] |
中国医师协会骨科学分会脊柱创伤专业委员会. 急性症状性骨质疏松性胸腰椎压缩骨折椎体强化术临床指南[J]. 中华创伤杂志, 2019, 35(6): 481-489. DOI:10.3760/cma.j.issn.1001-8050.2019.06.001 |
| [6] |
He S, Zhang Y, Lv N, et al. The effect of bone cement distribution on clinical efficacy after percutaneous kyphoplasty for osteoporotic vertebral compression fractures[J]. Medicine(Baltimore), 2019, 98(50): e18217. |
| [7] |
Zhang L, Wang Q, Wang L, et al. Bone cement distribution in the vertebral body affects chances of recompression after percutaneous vertebroplasty treatment in elderly patients with osteoporotic vertebral compression fractures[J]. Clin Interv Aging, 2017, 12: 431-436. DOI:10.2147/CIA.S113240 |
| [8] |
Ma XL, Xing D, Ma JX, et al. Risk factors for new vertebral compression fractures after percutaneous vertebroplasty[J]. Spine(Phila Pa 1976), 2013, 38(12): E713-E722. DOI:10.1097/BRS.0b013e31828cf15b |
| [9] |
Hong SJ, Lee S, Yoon JS, et al. Analysis of intradiscal cement leakage during percutaneous vertebroplasty: multivariate study of risk factors emphasizing preoperative MR findings[J]. J Neuroradiol, 2014, 41(3): 195-201. DOI:10.1016/j.neurad.2013.07.004 |
| [10] |
Ren H, Shen Y, Zhang YZ, et al. Correlative factor analysis on the complications resulting from cement leakage after percutaneous kyphoplasty in the treatment of osteoporotic vertebral compression fracture[J]. J Spinal Disord Tech, 2010, 23(7): e9-e15. DOI:10.1097/BSD.0b013e3181c0cc94 |
| [11] |
李玉伟, 王海蛟, 崔巍, 等. 极外侧穿刺法行经皮椎体成形术治疗骨质疏松性椎体压缩骨折[J]. 中国修复重建外科杂志, 2019, 33(5): 612-617. |
| [12] |
钟睿, 姜威, 熊森, 等. 单侧弯角与直行入路椎体成形治疗骨质疏松性椎体压缩骨折疗效的对照研究[J]. 中华创伤杂志, 2018, 34(2): 102-108. DOI:10.3760/cma.j.issn.1001-8050.2018.02.003 |
 2022, Vol.20
2022, Vol.20  Issue(2): 121-124
Issue(2): 121-124


