2. 首都医科大学附属北京天坛医院骨科, 北京 100050
2. Department of Orthopaedics, Beijing Tiantan Hospital, Capital Medical University, Beijing 100050, China
后纵韧带骨化症(OPLL)的特征是异位骨形成替代韧带组织[1-2]。OPLL在亚洲人中的发生率高于欧洲人和美国人,有报道[3]显示,OPLL在日本的发生率为1.9% ~ 4.3%,在中国为0.44% ~ 8.92%。目前OPLL的发生机制仍未完全阐明,遗传因素和环境因素在其发生过程中均起作用。既往研究[4-9]表明,遗传因素是OPLL的主要因素,并且和环境因素相互作用。骨形态发生蛋白(BMP)是转化生长因子-β(TGF-β)超家族的成员,BMP结合骨形态发生蛋白受体-ⅠA(BMPR-ⅠA)、BMPR-ⅠB和BMPR-Ⅱ,通过Smad信号转导通路刺激成骨细胞分化[10-11]。BMPR-ⅠA是BMPR家族的一种亚型,在BMP信号转导通路中起着重要调节作用[12-14]。既往研究[10]表明,BMPR-ⅠA在异位骨化的发生、发展中起着重要作用。本研究旨在探讨BMPR-ⅠA在OPLL发展中的作用,评估其是否为OPLL的易感基因,现报告如下。
1 材料与方法 1.1 主要试剂和仪器DNA纯化试剂盒(Promega公司,美国);C3H10T1/2细胞(北京协和细胞库,中国);引物和pcDNA3.1-BMPR-ⅠA质粒(Invitrogen公司,美国);ABI 3730XL POP7 DNA测序分析5.2系统(Applied Biosystems公司,美国);Lipofectamine 2000转染试剂盒、胎牛血清和培养基(Invitrogen公司,美国);BMPR-ⅠA特异性单克隆抗体(Santa Cruz公司,美国);P-Smad1/5/8和Smad4多克隆抗体(CST公司,美国);碱性磷酸酶(AKP/ALP)测试盒和骨钙素(OST)测试盒(南京建成生物工程研究所,
中国)。
1.2 材料获取选择首都医科大学附属北京地坛医院和天坛医院收治的292例OPLL患者和586名非OPLL者(表 1)。OPLL的诊断主要基于影像学检查,包括X线、CT和MRI。OPLL分型由侧位X线片和CT确定。根据影像学和实验室检查,排除强直性脊柱炎和其他代谢性疾病(如骨软化症、骨质疏松症、弥散性特发性骨骼肥大症或甲状旁腺功能亢进症)。本研究经医院伦理委员会审核批准(KY2011-005-01),所有参与者知情同意并签署知情同意书。
|
|
表 1 2组患者一般资料 |
使用DNA纯化试剂盒分离DNA,通过PCR扩增整个BMPR-ⅠA编码序列,通过ABI 3730XL POP7 DNA测序分析5.2系统对PCR产物进行基因分型,相关引物见表 2,排除杂合度未知且等位基因频率低于5%的SNP位点。
|
|
表 2 BMPR-ⅠA引物序列 |
取第10代C3H10T1/2细胞,按照1.5×104/孔的密度接种于6孔板内,待细胞生长至60% ~ 80%汇合时,使用Lipofectamine 2000通过pcDNA3.1-BMP2质粒进行转染。随机将细胞分为6组:正常组、空载体组、野生型组、rs34755052单突变组、rs11528010单突变组和双突变组。
1.5 蛋白质印迹法检测各组BMPR-ⅠA、P-Smad1/5/8和Smad4的表达用PBS缓冲液清洗3次,加入RIPA裂解液和蛋白酶抑制剂,匀浆器匀浆、4℃下12 000×g离心10 min(g=9.806 65 m/s2),取上清测定蛋白浓度,取等量蛋白提取物通过SDS-PAGE进行分离,电泳转移到硝酸纤维素膜上。将膜在5%脱脂牛奶的1×Tris缓冲盐水和1×TBST中封闭1 h,然后与特异性单克隆抗体在室温下孵育4 h,与二抗在室温下孵育1 h,通过化学发光进行显色,使用Kodak Image Station扫描并分析。
1.6 检测ALP和OC活性将细胞转入50 mmol Tris(pH 7.40)中,并通过超声裂解。采用酶联免疫吸附法,37℃时以10 mmol对硝基苯基磷酸酯为底物的测定缓冲液(100 mmol Sigma221缓冲液含10 mmol MgCl2,pH 10.3)中测试细胞裂解物的ALP和OC活性。使用OD405的光密度读取反应混合物,并使用对硝基苯酚的标准曲线(P-NP 500 nmol/ml,Sigma)作为参考。
1.7统计学处理
采用SPSS 25.0软件对数据进行统计分析,符合正态分布的计量资料以x±s表示,Hardy-Weinberg平衡以及基因型和等位基因分布采用χ2检验,组间比较采用独立样本t检验;以P < 0.05为差异有统计学意义。
2 结果 2.1 2组BMPR-ⅠA的SNP位点基因型和等位基因分布共鉴定12个既往报道过的BMPR-ⅠA的SNP位点,其中,rs34755052(C/T)和rs11528010(C/A)的频率组间差异有统计学意义(P < 0.05,表 3)。2个位点的基因型和等位基因分布比较,rs34755052(C/T)中“CC”“CT”和“TT”基因型差异有统计学意义(P < 0.05,表 3),且OPLL组中“C”“T”等位基因的频率低于非OPLL组,差异有统计学意义(P < 0.05,表 3)。rs11528010(C/A)中的“CC”“CA”和“AA”基因型差异有统计学意义(P < 0.05,表 3),且OPLL组中“C”“A”等位基因的频率低于非OPLL组,差异有统计学意义(P < 0.05,表 3)。
|
|
表 3 2组rs34755052(C/T)和rs11528010(C/A)的基因型和等位基因分布 |
蛋白质印迹法检测结果显示,野生型组、rs34755052单突变组、rs11528010单突变组、双突变组的BMPR-ⅠA蛋白表达明显高于正常组和空载体组,且各突变组均高于野生型组,差异具有统计学意义(P < 0.05,图 1)。
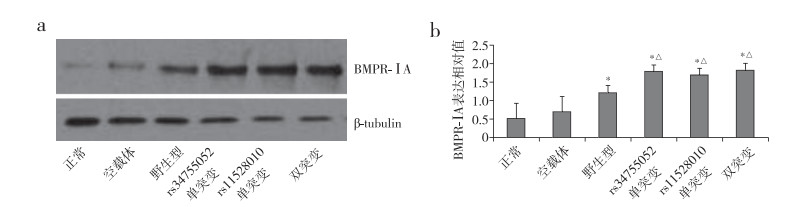
|
图 1 各转染组细胞BMPR-ⅠA蛋白表达 注:*与正常组和空载体组比较,P < 0.05;△与野生型组比较,P < 0.05。 |
蛋白质印迹法检测结果显示,野生型组、rs34755052单突变组,rs11528010单突变组、双突变组的P-Smad1/5/8蛋白表达明显高于正常组和空载体组,差异具有统计学意义(P < 0.05,图 2);且rs34755052单突变组和双突变组明显高于rs11528010单突变组和野生型组,差异具有统计学意义(P < 0.05,图 2)。各组P-Smad4蛋白表达差异无统计学意义(P > 0.05,图 3)。
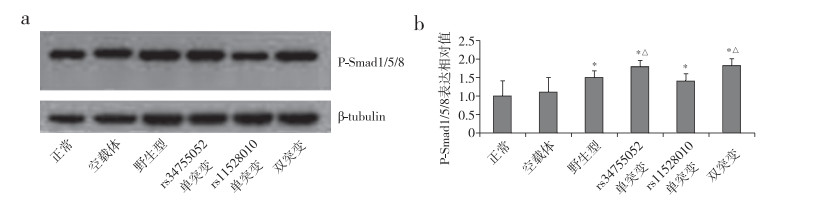
|
图 2 各转染组细胞P-Smad1/5/8蛋白表达 注:*与正常组和空载体组比较,P < 0.05;△与rs11528010单突变组和野生型组比较,P < 0.05。 |
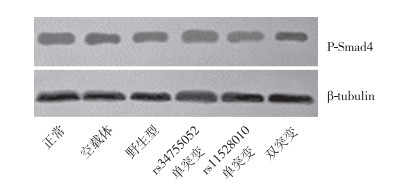
|
图 3 各转染组细胞P-Smad4蛋白表达 |
野生型组、rs34755052单突变组、rs11528010单突变组和双突变组的ALP活性明显高于正常组和空载体组,rs34755052单突变组高于其他突变组和野生型组,野生型组高于rs11528010单突变组,差异均有统计学意义(P < 0.05,表 4)。
野生型组和rs34755052单突变组的OC活性明显高于正常组和空载体组,差异有统计学意义(P < 0.05,表 4)。
|
|
表 4 各转染组细胞ALP和OC活性 |
BMPR-ⅠA可能在OPLL发展的不同阶段发挥重要作用。首先,病理学研究[15]发现,BMPR在OPLL患者的骨化韧带组织中高表达;其次,免疫组织化学研究[16]表明,骨化基质中存在BMPR-ⅠA;此外,还有研究[17-18]表明,微调水平的BMPR-ⅠA介导的信号对于牙齿和颞下颌关节的发育至关重要。
本研究首先分析了BMPR-ⅠA整个编码区内的遗传变异是否与OPLL发生有关,共鉴定了12个SNP位点,发现OPLL患者和非OPLL者的rs34755052(C/T)和rs11528010(C/A)位点频率不同。比较OPLL患者和非OPLL者2个SNP位点的基因型和等位基因的分布发现,rs34755052(C/T)中“CC”“CT”“TT”基因型有差异,rs11528010(C/A)中的“CC”“CA”“AA”基因型有差异,表明“CT”基因型和“CA”基因型与OPLL的发生有关。但是,鉴于rs34755052(C/T)位于BMPR-ⅠA基因的上游,而rs11528010(C/A)位于BMPR-ⅠA基因的第3外显子,该SNP位点对OPLL遗传易感性的影响尚不确定。既往研究[19]发现,BMPR-ⅠA基因上游有部分转录因子结合位点影响了BMPR-ⅠA的表达,并导致原本具有不良成骨活性的细胞发生钙化。因此,本研究组进一步检测这些SNP位点是否影响BMPR-ⅠA的基因表达和细胞内信号转导。BMP信号通路主要通过Smad介导的信号转导途径发生,在BMP信号通路中,P-Smad1/5/8和Smad4是关键蛋白,而ALP和OC是成骨细胞特异性蛋白[13, 20-22]。本研究发现,野生型组和各突变组表达的BMPR-ⅠA蛋白明显高于正常组和空载体组,而各突变组又高于野生型组,表明野生型或突变型载体可以成功转染到C3H10T 1/2细胞中并且可以稳定表达。野生型组和各突变型组表达的P-Smad1/5/8蛋白明显高于正常组和空载体组,其中rs34755052单突变组又高于其他突变组和野生型组,表明BMPR-ⅠA基因的rs34755052(C/T)位点与P-Smad1/5/8蛋白表达呈正相关。野生型组和各突变组ALP活性明显高于正常组和空载体组,其中rs34755052单突变组又高于其他突变组和野生型组,野生型组又高于rs11528010单突变组,表明BMPR-ⅠA基因的rs34755052(C/T)位点与ALP活性呈正相关。野生型组和rs34755052单突变组OC活性明显高于正常组和空载体组,表明BMPR-ⅠA基因的rs34755052(C/T)位点与OC活性呈正相关。综上,rs34755052(C/T)位点通过影响BMPR-ⅠA空间构象的核苷酸变化进而导致蛋白质功能异常。
早期的OPLL可采用非手术治疗,但大多数OPLL患者病情是进展性的,因此,常须手术治疗。近年来问世的新靶点药物或许能够为其提供新的治疗选择。Smad介导的信号通路在BMPR-ⅠA基因的SNP位点诱导OPLL的病理过程中起着重要作用,因此成为OPLL治疗的靶点之一,在以后的研究中,该领域还需要更进一步研究。有研究[23]发现,自然状态下骨化灶轴向长度每年增长约2.0 mm,厚度每年增长约0.2 mm,连续型和/或混合型骨化灶为骨化进展的主要危险因素。与自然进程相比,后路椎板切除融合术、各种前路手术均能减缓OPLL进展,而无内固定的椎板切除术、椎板成形术则会加快骨化进展。本研究中连续型和混合型OPLL患者约占53.4%,须引起重视。但是,该差异是否有其相应的遗传分子机制,尚须进一步研究。
本研究的局限性。首先,尽管C3H10T1/2细胞已被用作人类胚胎成纤维细胞的替代模型用来研究成骨细胞、脂肪细胞和软骨细胞分化的分子机制,但仍会出现不完全相同的表型导致偏差。其次,本研究组没有检测其他成骨基因的表达,例如Runt相关转录因子2(RUNX2)、Ⅰ型胶原蛋白alpha1(COL1A1)和骨桥蛋白(OPN),因此,无法了解其他易感基因及其致病性。此外,尽管BMPR-ⅠA基因中2个SNP位点与OPLL的发生有关,但其发生的详细机制仍然不完全清楚,在后续研究中,需要进一步研究明确BMPR-ⅠA的特定功能。
综上,BMPR-ⅠA是OPLL的易感基因之一。rs34755052(C/T)中的“CT”基因型和rs11528010(C/A)中的“CA”基因型与OPLL的发生有关。BMPR-ⅠA基因上游的rs34755052(C/T)位点与P-Smad1/5/8蛋白表达水平及ALP和OC活性呈正相关。Smad介导的信号通路在BMPR-ⅠA诱导OPLL的病理过程中起着重要作用。
| [1] |
王珑清, 许晨辉, 叶程, 等. 脊柱后纵韧带骨化症病因学研究进展[J]. 脊柱外科杂志, 2021, 19(2): 130-135. DOI:10.3969/j.issn.1672-2957.2021.02.012 |
| [2] |
赵春, 张长春, 周平辉, 等. 颈椎后纵韧带骨化症的研究进展[J]. 中华全科医学, 2020, 18(5): 821-825. |
| [3] |
Matsunaga S, Sakou T. Ossification of the posterior longitudinal ligament of the cervical spine: etiology and natural history[J]. Spine (Phila Pa 1976), 2012, 37(5): E309-E314. DOI:10.1097/BRS.0b013e318241ad33 |
| [4] |
Doi T, Sakamoto R, Horii C, et al. Risk factors for progression of ossification of the posterior longitudinal ligament in asymptomatic subjects[J]. J Neurosurg Spine, 2020, 8: 1-7. |
| [5] |
Xu G, Liu C, Liang T, et al. Integrated miRNA-mRNA network revealing the key molecular characteristics of ossification of the posterior longitudinal ligament[J]. Medicine (Baltimore), 2020, 99(21): e20268. DOI:10.1097/MD.0000000000020268 |
| [6] |
Ikegawa S. Genomic study of ossification of the posterior longitudinal ligament of the spine[J]. Proc Jpn Acad Ser B Phys Biol Sci, 2014, 90(10): 405-412. DOI:10.2183/pjab.90.405 |
| [7] |
Wang P, Liu X, Zhu B, et al. Association of IL17RC and COL6A1 genetic polymorphisms with susceptibility to ossification of the thoracic posterior longitudinal ligament in Chinese patients[J]. J Orthop Surg Res, 2018, 13(1): 109. DOI:10.1186/s13018-018-0817-y |
| [8] |
Khuyagbaatar B, Kim K, Park WM, et al. Biomechanical investigation of post-operative C5 palsy due to ossification of the posterior longitudinal ligament in different types of cervical spinal alignment[J]. J Biomech, 2017, 57: 54-61. DOI:10.1016/j.jbiomech.2017.03.019 |
| [9] |
陈广辉, 陈仲强, 杨晓曦, 等. 机械应力因素在脊柱韧带骨化发生机制中的作用研究进展[J]. 脊柱外科杂志, 2020, 18(3): 203-207. DOI:10.3969/j.issn.1672-2957.2020.03.013 |
| [10] |
Wang H, Jin W, Li H. Genetic polymorphisms in bone morphogenetic protein receptor typeⅠA gene predisposes individuals to ossification of the posterior longitudinal ligament of the cervical spine via the smad signaling pathway[J]. BMC Musculoskelet Disord, 2018, 19(1): 61. DOI:10.1186/s12891-018-1966-1 |
| [11] |
Liu S, Yin F, Fan W, et al. Over-expression of BMPR-IB reduces the malignancy of glioblastoma cells by upregulation of p21 and p27Kip1[J]. J Exp Clin Cancer Res, 2012, 31(1): 52. DOI:10.1186/1756-9966-31-52 |
| [12] |
Katagiri T, Watabe T. Bone morphogenetic proteins[J]. Cold Spring Harb Perspect Biol, 2016, 8(6): a021899. DOI:10.1101/cshperspect.a021899 |
| [13] |
Raja E, Komuro A, Tanabe R, et al. Bone morphogenetic protein signaling mediated by ALK-2 and DLX2 regulates apoptosis in glioma-initiating cells[J]. Oncogene, 2017, 36(35): 4963-4974. DOI:10.1038/onc.2017.112 |
| [14] |
Andrews MG, Del Castillo LM, Ochoa-Bolton E, et al. BMPs direct sensory interneuron identity in the developing spinal cord using signal-specific not morphogenic activities[J]. eLife, 2017, 6: e30647. DOI:10.7554/eLife.30647 |
| [15] |
Orzechowska S, Świsłocka R, Lewandowski W. Model of pathological collagen mineralization based on spine ligament calcification[J]. Materials (Basel), 2020, 13(9): 2130. DOI:10.3390/ma13092130 |
| [16] |
Orzechowska S, Wróbel A, Kozieł M, et al. Physicochemical characterization of mineral deposits in human ligamenta flava[J]. J Bone Miner Metab, 2018, 36(3): 314-322. DOI:10.1007/s00774-017-0835-6 |
| [17] |
Li L, Wang Y, Lin M, et al. Augmented BMPRIA-mediated BMP signaling in cranial neural crest lineage leads to cleft palate formation and delayed tooth differentiation[J]. PLoS One, 2013, 8(6): e66107. DOI:10.1371/journal.pone.0066107 |
| [18] |
Gu S, Wu W, Liu C, et al. BMPRIA mediated signaling is essential for temporomandibular joint development in mice[J]. PLoS One, 2014, 9(8): e101000. DOI:10.1371/journal.pone.0101000 |
| [19] |
Dahdaleh FS, Carr JC, Calva D, et al. SP1 regulates the transcription of BMPR1A[J]. J Surg Res, 2011, 171(1): e15-e20. DOI:10.1016/j.jss.2011.06.056 |
| [20] |
Ishan M, Chen G, Sun C, et al. Increased activity of mesenchymal ALK2-BMP signaling causes posteriorly truncated microglossia and disorganization of lingual tissues[J]. Genesis, 2020, 58(1): e23337. |
| [21] |
Li N, Liu J, Liu H, et al. Altered BMP-Smad4 signaling causes complete cleft palate by disturbing osteogenesis in palatal mesenchyme[J]. J Mol Histol, 2021, 52(1): 45-61. DOI:10.1007/s10735-020-09922-4 |
| [22] |
Yang J, Kitami M, Pan H, et al. Augmented BMP signaling commits cranial neural crest cells to a chondrogenic fate by suppressing autophagic β-catenin degradation[J]. Sci Signal, 2021, 14(665): eaaz9368. DOI:10.1126/scisignal.aaz9368 |
| [23] |
石维, 陈雄生. 颈椎后纵韧带骨化自然进程及外科干预的影响[J]. 中华骨科杂志, 2018, 38(24): 1537-1544. DOI:10.3760/cma.j.issn.0253-2352.2018.24.008 |
 2022, Vol.20
2022, Vol.20  Issue(4): 263-267
Issue(4): 263-267


