2. 长治医学院附属和平医院骨科,长治 046000;
3. 广西中医药大学附属瑞康医院中西医结合转化医学中心,南宁 530000
2. Department of Orthopaedics, Heping Hospital, Changzhi Medical College, Changzhi 046000, Shanxi, China;
3. Department of Translational Medicine Center for Integrated Traditional Chinese and Western Medicine, Ruikang Hospital, Guangxi University of Traditional Chinese Medicine, Nanning 530000, Guangxi Zhuang Autonomous Region, China
原发性骨质疏松症与年龄增长及妇女绝经有关,其特征是骨量减少,骨组织显微结构改变(松质骨骨小梁变细、断裂、数量减少,皮质骨多孔、变薄)以致骨脆性增高,易发生骨折[1-3]。原发性骨质疏松症的发生机制是骨形成和骨吸收动态平衡失调,骨吸收过度而新骨生成不足[4-5]。目前,临床上应用的抗骨质疏松药物主要分为骨吸收抑制剂和骨形成促进剂,虽然有一定的治疗作用,但是由于耦合效应,骨吸收抑制剂可引起骨形成减少,同样,骨形成促进剂也可引起骨吸收增加,从而限制了它们的功效[6]。深入了解成骨和破骨的分子机制有助于开发新的靶向治疗药物,如骨硬化蛋白(SOST)抑制剂和转化生长因子抑制剂等[7]。
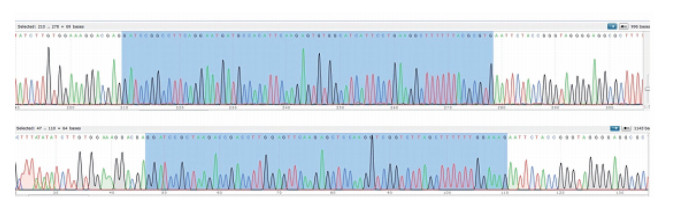
1 材料与方法 1.1 SOST基因沉默质粒构建首先经PubMed BLAST检索小鼠SOST基因序列,设计2条小鼠共打靶SOST基因沉默靶序列和1条阴性对照序列,根据所选用载体结构设计并合成61~63 nt的单核苷酸链,退火形成双链shRNA(表 1)。将磷酸化/退火反应体系放入热循环仪上,37℃ 30 min,95℃ 5 min,然后以5℃/min的速度快速降至25℃,单链oligos退火为双链oligos,测序结果显示目的双核苷酸链已经插入,证明SOST基因沉默载体构建成功(图 1)。将SOST基因沉默载体,阴性对照载体转染至小鼠骨细胞进行培养,并设置空白对照组(不转染任何载体),待细胞达到对数生长期时,裂解各组细胞,提取总蛋白,应用Western bloting检测各组sclerostin蛋白(SOST基因编码的蛋白)的表达差异,筛选出SOST基因沉默效果最好的载体。
|
|
表 1 SOST基因沉默靶序列 Tab. 1 SOST gene silencing target sequence |
|
图 1 SOST基因沉默双核苷酸链靶序列插入PLX-shRNA-1质粒后的测序 Fig. 1 Sequencing of SOST gene silencing dinucleotide chain target sequence after insertion into PLX-shRNA-1 plasmid |
将验证并筛选的效果最好的慢病毒SOST-RNAi载体、SOST-N阴性对照载体分别与包装载体系统一起转染293T细胞,包装为假病毒颗粒采用3种方式处理小鼠成骨细胞前体细胞MC3T3-E1:①多靶点SOST基因沉默技术修饰并同时转染CRISPR-sgRNA载体系统和SOST-RNAi修复模板载体假病毒颗粒;②同时转染CRISPR-sgRNA载体系统和SOST-N修复模板载体假病毒颗粒;③不作任何处理。所有细胞均在相同条件下进行培养。
取18只18月龄雌性C57BL/6小鼠(湖南斯莱克景达实验动物有限公司),麻醉后在无菌条件下手术切除双侧卵巢制作骨质疏松模型。模型制备成功后5周,分为3组(n=6):SOST基因沉默组注射采用多靶点SOST基因沉默技术修饰并同时转染CRISPR-sgRNA载体系统和SOST-RNAi修复模板载体假病毒颗粒的MC3T3-E1细胞;阴性组注射同时转染CRISPR-sgRNA载体系统和SOST-N修复模板载体假病毒颗粒的MC3T3-E1细胞;空白组注射不作任何处理的MC3T3-E1细胞。注射量均为200 μL(含2×109个细胞),每周注射1次,共注射4次。
1.3 小鼠椎体组织切片制作和染色观察各组小鼠在相同条件下继续喂养2个月后手术取出L1~3,将附着的肌肉组织剔除,用无菌蒸馏水反复冲洗。尽快对样品进行相应检测,暂不检测的样品保存于-80℃冰箱中。椎体组织用4%多聚甲酫溶液固定,经过脱钙、无水乙醇脱水、二甲苯中透明后石蜡包埋。将石蜡块先按组织的形状切割,然后进行切片、贴片。
1.3.1 HE染色取石蜡切片,脱蜡后放入双蒸水中漂洗10 min;用Mayer苏木精溶液染色10~15 min;双蒸水浸洗5 min;在0.5%盐酸-乙醇溶液中分色1 min;自来水浸洗20 min以上;双蒸水漂洗5 min;0.5%伊红染色1~2 min;95%乙醇脱水3 min,重复2次;100%乙醇脱水3 min,重复2次;二甲苯透明5 min,重复3次;中性树胶封片。切片于37℃烘箱干燥,在显微镜下观察,分析结果,采用Image J软件计算骨小梁面积。
1.3.2 Masson三色染色取石蜡切片,脱蜡后放入双蒸水中漂洗10 min;放入57℃烘箱中30 min,冷却20 min,二甲苯透明,梯度乙醇脱水;放入饱和苦味酸溶液1 h,自来水冲洗5~10 min;放入3% Weigert苏木精溶液染色20 min,自来水冲洗20 min;放入1%丽春红-酸性品红染色5 min,双蒸水漂洗30 s,重复2次;2%磷钨酸浸泡2 min;0.5%苯胺蓝水溶液浸泡8 min;1%醋酸浸泡1 min,重复2次;双蒸水漂洗30 s,重复2次;放入100%乙醇中浸泡2 min,重复2次;二甲苯溶液浸泡2 min,重复3次。中性树胶封片,37℃恒温干燥,保存,在显微镜下观察并分析结果,采用Image J软件计算骨小梁面积。
1.3.3 免疫组织化学染色取石蜡切片,脱蜡后放入PBS缓冲液中,经抗原修复液(Vector公司,美国)80℃加热20 min,缓冲液清洗2次,再入0.3%过氧过氢溶液内室温作用20 min,以消除内源性过氧化物酶。在2%小牛血清(Jackson公司,美国)溶液中孵育1 h,分别加兔抗小鼠OPG抗体和RANKL抗体(1∶100,ScienCell公司,美国)4℃孵育过夜。次日经缓冲液洗涤3次后,加相应山羊抗兔IgG二抗(1∶400,ScienCell,美国)溶液,室温孵育1 h,缓冲液洗涤3次后,加生物素与卵白素结合(ABC)试剂盒配制的混合液中孵育1 h。采用DAB显色试剂盒进行显色。呈色反应后,切片经逐级脱水并封片,显微镜下观察,采用Image J软件定量分析骨组织中OPG和RANKL表达的变化。
1.3.4 实时荧光定量PCR检测SOST和骨代谢相关细胞因子的表达用TRIzol Reagent裂解液提取小鼠L3总RNA,反转录为cDNA,采用实时荧光定量PCR检测各组细胞SOST和相关细胞因子的表达水平。PCR引物序列:SOST上游引物序列为5’-CGTGCCTCATCTGCCTACTT-3’,下游引物序列为5’-ACATCTTTGGCGTCATAGGG-3’,扩增片段长度为199 bp;RUNX2上游引物序列为5’-AACAACAGCAACAGCAACAA-3’,下游引物序列为5’-CGGTAACCACAGTCCCATCT-3’,扩增片段长度为300 bp;β-catenin上游引物序列为5’-CACTGGCAGCAGCAGTCTTA-3’,下游引物序列为5’-CCCTCATCTAGCGTCTCAGG-3’,扩增片段长度为248 bp;RANKL上游引物序列为5’-AGCCGAGACTACGGCAAG TA-3’,下游引物序列为5’-AGTACAGGAACAGAGCGATGC-3’,扩增片段长度为167 bp;骨保护素(OPG)上游引物序列为5’-GTTCCTGCACAGCTTCACAA-3’,下游引物序列为5’-AAACAGCCCAGTGACCATTC-3’,扩增片段长度为121 bp;内参GAPDH上游引物序列为5’-AGGTCGGTGTGAACGGATTTG-3’,下游引物序列为5’-TGTAGACCATGTAGTTGAGGTCA-3’,扩增片段长度为123 bp。用2-ΔΔCt法计算目的基因的相对表达量。
1.4 统计学处理使用SPASS 20.0软件分析、处理数据。符合正态分布的计量资料以x±s表示,多组间比较采用单因素方差分析,方差齐时用Dunnett t检验、方差不齐时用Dunnett T3检验进行两两比较;以P<0.05为差异有统计学意义。
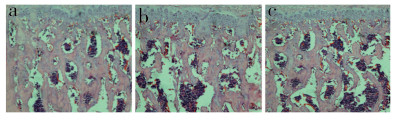
2 结果 2.1 HE染色SOST基因沉默组L1椎板下骨小梁面积(345 780.0±68 138.31)nm2明显高于阴性组(229 251.0±29 336.83)nm2和空白组(220 809.67±36 865.03)nm2,差异均有统计学意义(P<0.05,图 2);阴性组与空白组骨小梁面积差异无统计学意义(P>0.05,图 2)。
|
图 2 L1 HE染色(×10) Fig. 2 HE staining of L1(×10) a:SOST基因沉默组 b:阴性组 c:空白组 a: SOST gene silenced group b: Negative group c: Blank group |
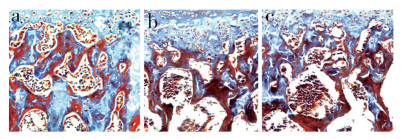
SOST基因沉默组L2椎板下骨小梁面积(383 554.67±28 059.27)nm2明显高于阴性组(240 354.0±26 178.69)nm2和空白组(251 062.0±18 607.67)nm2,差异均有统计学意义(P<0.05,图 3);阴性组与空白组骨小梁面积差异无统计学意义(P>0.05,图 3)。
|
图 3 L2 Masson三色染色(×10) Fig. 3 Masson trichrome staining of L2(×10) a:SOST基因沉默组 b:阴性组 c:空白组 a: SOST gene silenced group b: Negative group c: Blank group |
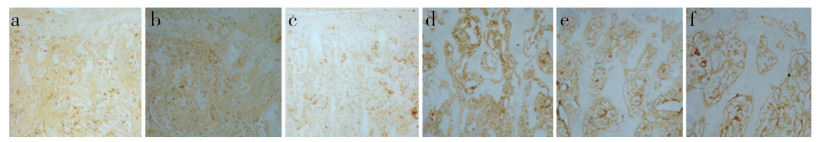
SOST基因沉默组OPG表达量(2.59±0.76)高于阴性组(0.65±0.10)和空白组(0.82±0.10),RANKL表达量(0.57±0.08)低于阴性组(1.21±0.15)和空白组(1.33±0.17),差异均有统计学意义(P<0.05,图 4);阴性组与空白组OPG和RANKL表达量差异均无统计学意义(P>0.05,图 4)。
|
图 4 L2免疫组织化学染色(×10) Fig. 4 Immunohistochemical staining of L2(×10) a:SOST基因沉默组OPG的表达 b:阴性组OPG的表达 c:空白组OPG的表达 d:SOST基因沉默组RANKL的表达 e:阴性组RANKL的表达 f:空白组RANKL的表达 a: OPG expression in SOST gene silenced group b: OPG expression in negative group c: OPG expression in blank group d: RANKL expression in SOST gene silenced group e: RANKL expression in negative group f: RANKL expression in blank group |
实时荧光定量PCR检测结果显示,SOST基因沉默组SOST和RANKL相对表达量低于阴性组,RUNX2、β-catenin和OPG相对表达量高于阴性组,差异均有统计学意义(P<0.05,图 5)。
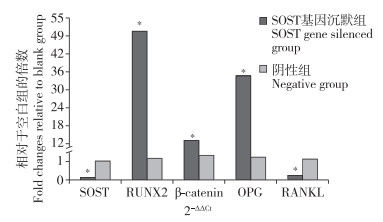
|
图 5 实时荧光定量PCR检测L3中相关因子表达 Fig. 5 Expression of related factors detected by real-time fluorescence quantitative PCR in L3 注:*与阴性组相比,P<0.05。 Note: *P < 0.05, compared with negative group. |
骨质疏松症已经成为一个世界范围的健康问题。骨质疏松症的发生率在老年妇女中为50%~60%,男性中为20%~30%[10];北京市和上海市71~80岁人群骨质疏松症发生率分别为73.1%和67.5%[11]。该病发生率高,保健费用消耗大,世界卫生组织将其列为老年人三大疾病之一[12]。
骨骼是一种具有高度复杂性和动态变化特性的结缔组织,破骨细胞重吸收和成骨细胞骨重建的平衡是维持骨稳态的关键[13]。RUNX2是调控骨形成的重要基因,有研究[14]证明,RUNX2基因缺失导致小鼠的成骨细胞缺乏。RUNX2上调成骨细胞相关基因,如COLIA1、ALP、BSP、BGLAP和OCN等[15]。RANK和RANKL是破骨细胞形成的关键因子,由成骨细胞、骨细胞和间质细胞分泌,二者结合后即可诱导破骨细胞形成[16]。OPG由成骨细胞、间质细胞、成纤维细胞等多种细胞分泌,OPG与RANKL结合后可阻止RANK/RANKL相互作用,抑制破骨细胞形成[17]。β-catenin是另一个调节骨代谢的关键因子,激活Wnt/β-catenin信号传递,促进成骨细胞增殖分化,抑制破骨细胞增殖分化,改善骨代谢[18]。由此可见,成骨细胞可分泌调控成骨细胞和破骨细胞分化和成熟的主要细胞因子,即成骨细胞的分化和活性是骨重建的关键。
骨代谢是一个复杂的过程,受到局部微环境和全身因素的影响,包括激素(雌激素和甲状旁腺激素等)、细胞因子、趋化因子和生物力学刺激等[19-22]。这些因素通过多种信号通路影响成骨细胞和破骨细胞的分化和活性,而SOST参与多种信号通路的活性调节。①SOST抑制Wnt/β-catenin信号传递,从而抑制成骨细胞分化、增殖和活性,导致骨形成减少[6]。任艳霞等[23]对156例绝经后2型糖尿病患者血清SOST表达与骨密度相关关系的研究证实,绝经后2型患者SOST高表达可能导致骨代谢异常,引起骨密度降低,增加骨质疏松发生的风险;相反,SOST功能的缺失能够导致人类和鼠的骨密度增高[24]。②TGF-β/BMP通路是影响骨代谢的另一个信号转导途径。SOST主要通过竞争性结合Ⅰ型和Ⅱ型受体来抑制TGF-β/BMP通路,从而抑制成骨细胞分化及骨形成[24]。③甲状旁腺激素(PTH)通过cAMP/PKA信号途径抑制SOST表达[25],PTH也可通过肌细胞促进因子2(Mef2)来抑制SOST增强子的转录活性[26]。④Huang等[27]的研究证明,SOST转录起始位点上游10 kb区域存在3个潜在的雌激素受体反应元件(ERE)。在成骨细胞中,雌激素信号与BMP2信号传递相互作用以间接的方式负调控SOST表达,并且,这种调控方式涉及Wnt/雌激素受体α和β-catenin信号通路[28]。⑤SOST启动子上游有一个140 bp的元件,含有2个E-box、C/EBP和RUNX2的结合位点,该元件是SOST基因转录活性所必需的[29]。因此,SOST可以影响RUNX2的表达。⑥Yang等[30]发现,SOST也是成骨转录因子Osterix的靶基因,Osterix的结合位点位于SOST基因上游100~260 bp区域,Osterix的C末端含有能结合到特定GC富集区的DNA结合域,促进SOST启动子活性,从而调节SOST蛋白的表达水平。SOST是一种多肽类骨相关蛋白,是骨细胞衍生的骨形成负调节因子[31]。高特异性的表达模式和独特的骨表型使SOST成为治疗骨质疏松等代谢性骨病和进行骨折修复的一个很有吸引力的治疗靶点[32]。SOST抗体是最近研究的热点之一,包括romosozumab和blosozumab,它们可以引起骨形成标志物的迅速增加,骨吸收标志物持续下降,骨密度显著增加[3]。
随着基因修饰技术的进步,开发基因治疗的新方法势在必行。本研究采用多靶点基因沉默技术,大大提高了沉默SOST基因表达的效率。将多靶点沉默SOST基因修饰的MC3T3-E1细胞通过尾静脉注射到骨质疏松模型小鼠体内2个月后,观察到小鼠椎板下骨小梁面积明显增加,且椎体组织中RUNX2、β-catenin、OPG基因表达增强,RANKL基因表达减弱,说明注射SOST基因沉默的MC3T3-E1细胞能使骨质疏松小鼠软骨层下骨小梁形成增多,显著增强成骨能力。
综上所述,沉默SOST基因修饰干细胞治疗的应用有望增强骨质疏松小鼠成骨细胞的分化和活性,达到治疗骨质疏松、降低骨折风险的目的。
| [1] |
李少华, 张铁山, 邢克炎, 等. 转录激活因子4过表达在内质网过度应激所致骨质疏松中的意义[J]. 脊柱外科杂志, 2021, 19(4): 259-264. DOI:10.3969/j.issn.1672-2957.2021.04.009 |
| [2] |
陈莹, 盛珺, 刘达, 等. 唑来膦酸改善骨质疏松患者后路腰椎椎间融合术后腰痛[J]. 脊柱外科杂志, 2019, 17(5): 319-323. DOI:10.3969/j.issn.1672-2957.2019.05.005 |
| [3] |
崔轶, 雷伟, 吴子祥, 等. 骨质疏松大动物模型的研究进展[J]. 脊柱外科杂志, 2010, 8(5): 316-320. DOI:10.3969/j.issn.1672-2957.2010.05.016 |
| [4] |
程亚军, 陈绍丰, 李明, 等. 骨转换标志物在绝经后骨质疏松症中的临床应用[J]. 海军军医大学学报, 2022, 43(2): 182-187. |
| [5] |
段煜东, 张子程, 李博, 等. Hippo信号通路在成骨代谢中的研究进展[J]. 第二军医大学学报, 2021, 42(3): 314-319. DOI:10.16781/j.0258-879x.2021.03.0314 |
| [6] |
Makras P, Delaroudis S, Anastasilakis AD. Novel therapies for osteoporosis[J]. Metabolism, 2015, 64(10): 1199-1214. DOI:10.1016/j.metabol.2015.07.011 |
| [7] |
Rossi V, Lee B, Marom R. Osteogenesis imperfecta: advancements in genetics and treatment[J]. Curr Opin Pediatr, 2019, 31(6): 708-715. DOI:10.1097/MOP.0000000000000813 |
| [8] |
Kedlaya R, Veera S, Horan DJ, et al. Sclerostin inhibition reverses skeletal fragility in an Lrp5-deficient mouse model of OPPG syndrome[J]. Sci Transl Med, 2013, 5(211): 211ra158. |
| [9] |
Li J, Ren Y, Li S, et al. Relationship between sclerostin(SOST) expression and genetic loci rs851056, rs1230399 polymorphisms and bone mineral density in postmenopausal women with type diabetes in Xinjiang[J]. Diabetes Metab Syndr Obes, 2021, 14: 4443-4450. DOI:10.2147/DMSO.S305831 |
| [10] |
王洪复. 老年性骨质疏松症病理机制与防治原则[J]. 中华保健医学杂志, 2010, 12(1): 1-4. |
| [11] |
费琦, 张效栋, 林吉生, 等. 北京市方庄社区70岁以上男性骨质疏松症患病率及其临床危险因素调查[J]. 中国全科医学, 2015, 18(35): 4344-4348. DOI:10.3969/j.issn.1007-9572.2015.35.018 |
| [12] |
杨志鹏, 魏成建, 龚双全. 骨质疏松症的中医治疗研究进展[J]. 中国骨质疏松杂志, 2015, 21(11): 1381-1384. DOI:10.3969/j.issn.1006-7108.2015.11.019 |
| [13] |
Florencio-Silva R, Sasso GR, Sasso-Cerri E, et al. Biology of bone tissue: structure, function, and factors that influence bone cells[J]. Biomed Res Int, 2015, 2015: 421746. |
| [14] |
Hagh FM, Noruzinia M, Mortazavi Y, et al. Different methylation patterns of RUNX2, OSX, DLX5 and BSP in osteoblastic differentiation of mesenchymal stem cells[J]. Cell J, 2015, 17(1): 71-82. |
| [15] |
Fakhry M, Hamade E, Badran B, et al. Molecular mechanisms of mesenchymal stem cell differentiation towards osteoblasts[J]. World J Stem Cells, 2013, 5(4): 136-148. DOI:10.4252/wjsc.v5.i4.136 |
| [16] |
Crockett JC, Mellis DJ, Scott DI, et al. New knowledge on critical osteoclast formation and activation pathways from study of rare genetic diseases of osteoclasts: focus on the RANK/RANKL axis[J]. Osteoporos Int, 2011, 22(1): 1-20. DOI:10.1007/s00198-010-1272-8 |
| [17] |
Longhini R, Aparecida de Oliveira P, Sasso-Cerri E, et al. Cimetidine reduces alveolar bone loss in induced periodontitis in rat molars[J]. J Periodontol, 2014, 85(8): 1115-1125. DOI:10.1902/jop.2013.130453 |
| [18] |
Lu S, Sun C, Miao C, et al. ERβ compensates for the absence of ERα function to promote osteoblast viability by inhibition of SOST signaling[J]. Exp Ther Med, 2017, 14(4): 3387-3392. DOI:10.3892/etm.2017.5014 |
| [19] |
Xiong J, Piemontese M, Onal M, et al. Osteocytes, not osteoblasts or lining cells, are the main source of the RANKL required for osteoclast formation in remodeling bone[J]. PLoS One, 2015, 10(9): e0138189. DOI:10.1371/journal.pone.0138189 |
| [20] |
鲁世金, 张宏其, 高其乐, 等. 雌激素受体基因ERβ与小鼠成骨细胞的增殖和分化[J]. 中国组织工程研究与临床康复, 2011, 15(28): 5157-5160. |
| [21] |
鲁世金, 张宏其, 高琪乐, 等. ERβ通过调控OPG/RANK/RANKL信号通路调控小鼠成骨细胞的成骨能力[J]. 中国现代医学杂志, 2011, 21(33): 4099-4102, 4108. DOI:10.3969/j.issn.1005-8982.2011.33.001 |
| [22] |
Pathak JL, Bravenboer N, Luyten FP, et al. Mechanical loading reduces inflammation-induced human osteocyte-to-osteoclast communication[J]. Calcif Tissue Int, 2015, 97(2): 169-178. DOI:10.1007/s00223-015-9999-z |
| [23] |
任艳霞, 李军, 李思源, 等. 绝经后2型糖尿病患者血清骨硬化蛋白表达与骨密度关系的研究[J]. 中国糖尿病杂志, 2021, 29(9): 683-687. DOI:10.3969/j.issn.1006-6187.2021.09.007 |
| [24] |
Kamiya N. The role of BMPs in bone anabolism and their potential targets SOST and DKK1[J]. Curr Mol Pharmacol, 2012, 5(2): 153-163. DOI:10.2174/1874467211205020153 |
| [25] |
Keller H, Kneissel M. SOST is a target gene for PTH in bone[J]. Bone, 2005, 37(2): 148-158. DOI:10.1016/j.bone.2005.03.018 |
| [26] |
Leupin O, Kramer I, Collette NM, et al. Control of the SOST bone enhancer by PTH using MEF2 transcription factors[J]. J Bone Miner Res, 2007, 22(12): 1957-1967. DOI:10.1359/jbmr.070804 |
| [27] |
Huang QY, Li GH, Kung AW. The -9247 T/C polymorphism in the SOST upstream regulatory region that potentially affects C/EBPalpha and FOXA1 binding is associated with osteoporosis[J]. Bone, 2009, 45(2): 289-294. DOI:10.1016/j.bone.2009.03.676 |
| [28] |
Kim RY, Yang HJ, Song YM, et al. Estrogen modulates bone morphogenetic protein-induced sclerostin expression through the Wnt signaling pathway[J]. Tissue Eng Part A, 2015, 21(13/14): 2076-2088. |
| [29] |
Sevetson B, Taylor S, Pan Y. Cbfa1/RUNX2 directs specific expression of the sclerosteosis gene (SOST)[J]. J Biol Chem, 2004, 279(14): 13849-13858. DOI:10.1074/jbc.M306249200 |
| [30] |
Yang F, Tang W, So S, et al. Sclerostin is a direct target of osteoblast-specific transcription factor osterix[J]. Biochem Biophys Res Commun, 2010, 400(4): 684-688. DOI:10.1016/j.bbrc.2010.08.128 |
| [31] |
Ramil FF, China KY. A review of the potential application of osteocyte-related biomarkers, fibroblast growth factor-23, sclerostin, and dickkopf-1 in predicting osteoporosis and fractures[J]. Diagnostics(Basel), 2020, 10(3): E145. |
| [32] |
Sebastian A, Loots GG. Genetics of Sost/SOST in sclerosteosis and van Buchem disease animal models[J]. Metabolism, 2018, 80: 38-47. DOI:10.1016/j.metabol.2017.10.005 |
| [33] |
Sharifi M, Ereifej L, Lewiecki EM. Sclerostin and skeletal health[J]. Rev Endocr Metab Disord, 2015, 16(2): 149-156. DOI:10.1007/s11154-015-9311-6 |
 2022, Vol.20
2022, Vol.20  Issue(5): 327-333
Issue(5): 327-333


