2. 上海市徐汇区中心医院骨科, 上海 200031
2. Department of Orthopaedics, Shanghai Xuhui Central Hospital, Shanghai 200031, China
骨质疏松性椎体压缩性骨折(OVCF)是骨质疏松症最常见的并发症。据报道,全世界50岁以上人群OVCF的发生率为11% ~ 50%[1],我国65岁以上的老年人群中约有15.7%的男性和34.5%的女性受到OVCF的困扰[2]。目前临床上最常用的治疗OVCF方法为经皮椎体强化术,使用最多的填充材料为聚甲基丙烯酸甲酯(PMMA)骨水泥。
随着经皮椎体强化术的广泛应用,其术后并发症也逐步引起重视,其中相邻椎体新发骨折是一个热点问题。临床上常出现“骨折-强化-再骨折-再强化”的恶性循环,不仅给患者身心健康带来极大伤害,同时也极大地困扰了脊柱外科医师。目前,已有多项研究[3-5]探讨了经皮椎体强化术后继发相邻椎体压缩性骨折的危险因素,包括患者的基础情况、手术方式、骨水泥的材料学特性及分布模式、脊柱矢状位失衡、初始伤椎的节段与数量、骨折的压缩程度、邻近椎间盘是否发生退行性变等,但尚不能确定相邻椎体新发骨折与经皮椎体强化术本身是否存在必然联系,经皮椎体强化术是否会导致邻近节段应力集中、增加相邻椎体骨折的发生率仍然存在较大的争议。学者们[6-9]采用三维有限元模型、人类尸体标本模型、动物脊椎椎体体外脱钙模型等探讨了经皮椎体强化术后相邻椎体的生物力学变化,但所得结论并不一致,甚至完全相反。本研究通过建立雌性山羊骨质疏松模型模拟人类女性绝经后骨质疏松症,测量山羊椎体强化后相邻椎体的生物力学变化,初步探讨椎体强化术本身是否为相邻椎体骨折的潜在危险因素。
1 材料与方法 1.1 实验动物健康雌性崇明山羊12只[上海交大农生实验实习场有限公司,动物生产许可证号SCXK(沪)2022-005],年龄为(3.0±0.5)岁,体质量为(22.69±2.25)kg,通过医院实验动物伦理委员会审查并排除传染病史、手术史、药物服用史后纳入本研究。
1.2 骨质疏松模型的建立山羊经丙泊酚辅以气管插管麻醉,呈仰卧位,四肢固定。在耻骨联合近端做腹正中切口,分离腹肌至腹白线。切开腹白线进入腹腔,找到膀胱及其深部的子宫,将膀胱推向远侧,并将子宫脱出腹腔。沿子宫角寻找到双侧卵巢,游离卵巢并结扎输卵管,切断卵巢固有韧带,取出卵巢(图 1a),回纳子宫后依次缝合。术后4周起予以甲泼尼龙琥珀酸钠5 mg/kg肌内注射,每周3次(周一、周三、周五),术后6个月停止注射[10]。术前及术后6个月分别应用双能X线骨密度仪测量山羊T13 ~ L2椎体骨密度,术前T13 ~ L2椎体平均骨密度为(0.897±0.091)g/mm3,术后6个月为(0.658±0.073)g/mm3,术后6个月骨密度与术前相比降低(26.6±2.3)%,差异有统计学意义(P < 0.05),表明山羊骨质疏松模型构建成功。
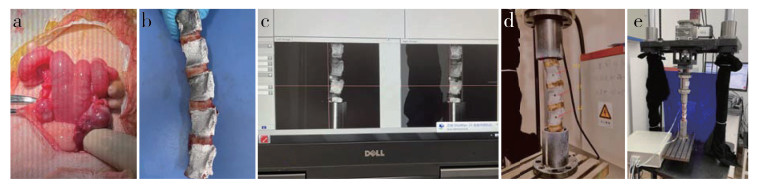
|
图 1 山羊骨质疏松模型的建立及椎体标本生物力学测试 Fig. 1 Establishment of osteoporosis model in goats and biomechanical test of vertebrae a:双侧卵巢切除术 b:标本散斑喷射 c:应变图像拍摄及计算机分析 d:拍摄记录载荷-位移曲线 e:轴向载荷下应力测试 a: Bilateral ovariectomy b: Spray speckles on specimen c: Strain image capture and computer analysis d: Record load-displacement curve e: Stress test with axial load |
将12只骨质疏松山羊随机分为对照组和实验组,每组6只。对照组不进行手术,实验组行L1椎体强化术。手术步骤:山羊经丙泊酚辅以气管插管麻醉,取俯卧位,四肢固定。用克氏针体外定位L1椎弓根平面并做标记,在背部标记处做长约3 cm正中切口,依次切开皮肤和皮下组织,剥离并推开椎旁肌,显露L1棘突、椎板及关节突关节;在直视下沿双侧关节突外下方经椎弓根置入带导针套筒,经C形臂X线机正侧位透视确认导针位置满意后,调制PMMA骨水泥(Eurofix VTP,产品型号884108,液体成分10 mL,粉体成分25 g)并沿套筒缓慢推注,每侧各注入1 mL,推注完毕后拔出套筒,逐层缝合。推注骨水泥时采用C形臂X线机透视,观察有无骨水泥渗漏。
1.4 生物力学测试术后1周处死所有山羊,取T12 ~ L3节段,仅保留椎体和椎间盘组织,用细砂纸打磨椎体表面。通过X线片观察骨水泥分布情况。标本冷冻保存,生物力学测试前室温下自然解冻。标本首先进行散斑喷射(图 1b),待喷漆完全干燥后将标本两端用牙托粉固定于定制工装里。
应变测量:将工装两端固定于疲劳试验机上。载荷精确度为0.01 N,位移精确度为0.01 mm,以5 mm/min的速度于T12表面施加0~400 N轴向压力,在此过程中,使用Aramis三维运动和变形测量系统中高速相机以7张/s进行拍摄,拍摄的图像经计算机处理后获取轴向加压400 N时T13、L1、L2椎体的应变图像(图 1c)及应变值。
刚度测量:将直径为3 mm的黑底白圈标记点分别粘贴于T13、L1、L2椎体左侧表面中心,同样予以0~400 N轴向压力,在此过程中,使用Aramis三维运动和变形测量系统高速相机以7张/s对3个标记点进行拍摄,获取轴向加压0~400 N时3个标记点的相对位移,经计算机处理后形成载荷-位移曲线,计算并得出2组在轴向400 N载荷下T13、L1、L2椎体的刚度(图 1d)。
应力测量:将2个Flexiforce A201传感器一端插入椎间隙,分别紧贴T13下终板及L2上终板,另一端连接肌张力测试系统,载荷精确度为0.01 N,位移精确度为0.01 mm,以5 mm/min的速度于T12表面施加0~400 N轴向压力,记录传感器输出的电压变化后,经转化,测出T13下终板及L2上终板在400 N轴向压力下的应力值(图 1e)。
1.5 统计学处理使用SPSS 22.0软件对数据进行统计分析。符合正态分布的计量资料以x±s表示,组内比较采用配对样本t检验,组间比较采用独立样本t检验;以P < 0.05为差异有统计学意义。
2 结果在轴向载荷400 N下,实验组强化椎体L1应变比对照组降低(31.7±2.8)%,相邻椎体T13及L2应变分别比对照组增加(43.8±3.2)%和(33.8±3.1)%,差异均有统计学意义(P < 0.05)。对照组内T13与L2应变差异无统计学意义(P > 0.05,表 1),实验组内T13应变大于L2,差异有统计学意义(P < 0.05,表 1)。实验组强化椎体L1相对位移比对照组少,差异有统计学意义(P < 0.05,表 1);2组相邻椎体T13及L2相对位移差异均无统计学意义(P > 0.05,表 1)。实验组强化椎体L1刚度比对照组增加(25.5±1.1)%,差异有统计学意义(P < 0.05,表 1);2组相邻椎体T13及L2刚度差异均无统计学意义(P > 0.05,表 1)。实验组T13下终板及L2上终板应力分别较对照组增加(47.3±3.4)%和(29.4±2.1)%,差异有统计学意义(P < 0.05);实验组内T13下终板应力较L2上终板应力更大,差异有统计学意义(P < 0.05,表 1)。
|
|
表 1 轴向载荷400 N下对照组与实验组椎体应变、刚度和应力的比较 Tab. 1 Comparison of vertebral strain, rigidity and stress between control and experimental group under 400 N-axial load |
为了研究椎体强化术对相邻椎体的生物力学影响,学者们建立了包括三维有限元、人类脊柱尸体标本、动物脊椎体外脱钙等多种模型,然而,由于建模方式不同,纳入或排除标准不同,所得结果差异极大,甚至完全相反[6-9]。Tsouknidas等[6]通过有限元分析对经皮椎体强化术后相邻椎体做力学测试,发现相邻椎体终板应力没有改变。杨小彬等[9]通过有限元分析后认为,伤椎强化后可引起相邻椎体生物力学分布的变化,相邻椎体应力增加约18%。同样的研究而结论相悖的原因可能是有限元研究时网格划分、建模方法并没有统一的标准,主观性较大。CT对椎间盘、终板、韧带等组织无法在原始模型中进行构建,只能通过软件进行重构,其参数设置亦没有统一的标准。有限元分析法在对脊柱运动变化时进行生物力学测定存在不足[11]。
动物脊椎体外脱钙是简单经济的建模方法。王志坤等[12]通过采用输液泵经山羊椎弓根孔灌注酸性溶液,使椎体骨密度平均下降了32.3%。但体外脱钙与人体骨质疏松产生的机制并不相同,仅分解了松质骨内的钙羟基磷灰石,使椎体的结构强度发生变化,而椎体内骨胶原及骨小梁的结构和数量并未改变,导致骨水泥难以注入,且不能形成良好弥散。在人类脊柱尸体标本进行生物力学测试所得出的结果最真实有效。但是,人类尸体标本稀缺,且标本经过甲醛溶液固定后,即使椎体存在骨质疏松,在没有骨折的状态下依旧难以大量注入骨水泥,且注入的骨水泥也因脱离机体内环境而难以形成良好弥散,仅能呈团块状分布,与实际手术时骨水泥多呈海绵状的弥散状态不同。
本研究组用雌性山羊建立骨质疏松模型,雌性山羊去卵巢后激素分泌情况及骨代谢情况与绝经后女性相似,能很好地模拟人类女性绝经后骨质疏松状态[13],本研究中山羊去卵巢后T13 ~ L2椎体的平均骨密度值下降约27%,达到了骨质疏松诊断标准。去卵巢模型的椎体皮质骨及松质骨同时发生骨质疏松,椎体内骨胶原流失,骨小梁数量减少、厚度变薄,能轻易地经双侧椎弓根在椎体内注入骨水泥,且因血液流动等机体内环境的影响使骨水泥良好弥散,能很好地模拟人类椎体强化术的效果。本研究仅观察了强化椎体对相邻椎体的力学影响,建立在无骨折的基础上,避免了骨折造模后复位不足或过度复位导致矢状位失衡而影响实验结果;术中透视及双侧注入骨水泥能有效避免骨水泥渗漏及分布不均衡。
目前,关于相邻椎体生物力学的研究大多集中在应力变化,且观点不同。Aquarius等[3]对尸体的生物力学进行测定,结果显示,经皮椎体强化术后相邻椎体终板应力峰值并未增加,推测相邻椎体骨折是骨质疏松的自然进程。Tsouknidas等[6]通过三维有限元分析亦得出相邻椎体终板应力没有改变的结论。但也有学者持不同观点。有研究[14-15]指出,在中立位时,伤椎强化后上位椎体的应力明显增加,且应力随载荷增加而逐渐加大,相邻椎体骨折与术后伤椎邻近终板应力增大、凸起增加有关。Polikeit等[16]通过建立L2,3椎体有限元模型发现,即使注入少量骨水泥,也可使相邻椎体应力和应变发生显著改变,增加相邻椎体终板的形变,增加相邻椎体骨折的发生率。Wang等[17]通过模拟骨水泥流动状态下注入椎体的有限元模型发现,相邻椎体终板的最大应力显著加大,而上位椎体下终板应力增加最大。
刚度亦是众多学者关注点之一,但对强化椎体的刚度是否发生变化仍有不同的观点。有学者[18]认为,骨水泥注入骨折椎体后,其强度能有效恢复,但刚度尽管较骨折后有明显升高,但仍不能恢复到骨折前水平。但也有学者[19]认为,当骨水泥体积分数达到15%时,伤椎刚度即可恢复到骨折前水平,且随着骨水泥注入量增多,伤椎刚度增加并对相邻椎体产生力学影响。有研究[20]报道,对骨密度正常的椎体行强化术,术后椎体刚度无明显变化,但骨质疏松椎体强化术后刚度增加1.74倍。Higgins等[21]发现,椎体的骨密度越低,骨水泥强化后椎体的刚度恢复越多,由此推断,松质骨的强度和刚度与骨密度呈正相关。
本研究结果表明,PMMA骨水泥强化椎体后,上位椎体应变增加约44%,其下终板应力增加约47%;下位椎体应变增加约34%,其上终板应力增加约29%;强化椎体应变下降约32%,而刚度增加约26%。PMMA骨水泥强化后椎体刚度增加、相邻椎体应力及应变增加应与椎体自身的解剖结构及PMMA骨水泥的高弹性模量有关。在结构上,成人椎体终板为轻度内凹的骨性终板,构成了椎间盘的上下边界,位于椎体的松质骨和椎间盘之间,起到平衡分散应力的作用,有“蛋壳样”效应。在正常脊柱节段中,相邻终板应力变化呈对称性。PMMA骨水泥具有强度高、固化快、黏滞度低、容易灌注等优点,能即刻恢复椎体强度、迅速缓解患者疼痛,但其刚度大、不可降解、无骨诱导性。虽然其具有足够的抗压强度,但弹性模量为2 500 ~ 3 700 MPa,而人体松质骨弹性模量仅为50 ~ 800 MPa[22],在骨质疏松的情况下,两者差异更大。椎体注入PMMA骨水泥后与相邻椎体间力学性能的巨大差异将导致应力遮挡,使应力集中在相邻椎体,且骨水泥的墩柱作用破坏了终板内凹及“蛋壳样”效应,使应力难以分散,故当载荷过大或患者骨质过于疏松时,相邻椎体终板承受了更大的应力,而相邻椎体因弹性形变加大率先发生骨折。尽管低弹性模量的骨水泥对相邻椎体终板产生的应力影响更小[23-25],但无论是磷酸钙、Cortoss或玻璃-聚醛酸骨水泥均存在力学强度差、脆性大、显影不佳、降解不稳定等特点,且迅速止痛效果远不如PMMA,故目前PMMA骨水泥仍是经皮椎体强化术中的首选材料。
正因为相邻椎体骨折的机制并不完全明确,故临床上对于预防相邻椎体骨折注射骨水泥是否必要仍有很大争议。尽管至今尚未形成预防性治疗的原则,但已有多位学者在临床上开展了此术式,并取得满意的疗效。Yen等[26]的一项回顾性分析表明,35例行预防性相邻椎体减量强化(注射部位仅为上位椎体下终板及下位椎体上终板)的患者与33例未行预防性相邻椎体强化的患者相比,其术后6个月、12个月、48个月新发骨折的发生率分别为3%和24%、3%和30%、3%和39%,故认为预防性相邻椎体减量强化能促使应力分散,是预防相邻椎体骨折的有效方法。Lei等[27]的一项回顾性研究对胸腰段OVCF患者经皮椎体后凸成形术后资料进行分析,结果表明,相邻椎体预防性减量强化患者1年内相邻椎体骨折的发生率为10.3%,非预防性强化患者为24.4%,并认为对胸腰段OVCF患者应行相邻椎体预防性强化。Kurutz等[28]对24具人类尸体的76个非骨折骨质疏松椎体进行体外压缩试验及生物力学研究,发现强化椎体的刚度明显增加,建议对严重骨质疏松的患者进行预防性相邻椎体强化。但也有学者持不同观点,Becker等[29]将60例单节段椎体压缩性骨折患者随机分为预防组和对照组,随访1年后发现2组相邻椎体骨折的发生率没有明显差别,故认为预防性相邻椎体强化并不会降低相邻椎体新发骨折,相邻椎体骨折是骨质疏松症的自然进程。本研究组认为,仅预防性强化相邻椎体上、下终板可以使应力得到有效分散,有助于降低相邻椎体骨折的发生率,但开展相邻椎体预防性强化治疗仍需谨慎,相邻椎体骨折的发生有多种高危因素,而相邻椎体生物力学变化仅为其中之一。尽管强化椎体会对相邻椎体的生物力学产生影响,但应力、应变增加到何种程度或什么样的载荷会导致相邻椎体骨折仍需生物力学研究进一步证实。
综上所述,骨质疏松山羊椎体经PMMA骨水泥强化后其相邻椎体终板均有应力增加,上位椎体应力增加更大,与临床上相邻椎体骨折多见于上位椎体相符。强化椎体刚度增加而应变下降,相邻椎体应变增加。椎体强化后,脊柱的生物力学随之发生改变,是相邻椎体骨折的潜在高危因素。对于伴有其他相邻椎体骨折高危因素(如严重骨质疏松胸腰段椎体压缩性骨折)的患者,预防性相邻节段减量注射骨水泥可能是预防相邻椎体骨折行之有效的办法。本研究的不足之处在于未对强化椎体上、下相邻椎体做减量注射后的生物力学进行测试,故不清楚相邻椎体注射骨水泥的减量幅度,及是否需要梯度注射多节椎体才能使应力不再集中于相邻椎体,达到以伤椎为中心的应力均匀分布,这有待于后续进一步进行实验模型设计及生物力学测试加以探讨。
| [1] |
Ballane G, Cauley JA, Luckey MM, et al. Worldwide prevalence and incidence of osteoporotic vertebral fractures[J]. Osteoporos Int, 2017, 28(5): 1531-1542. DOI:10.1007/s00198-017-3909-3 |
| [2] |
Deng M, Zeng XJ, He LC, et al. Osteoporotic vertebral fracture prevalence in elderly chinese men and women: a comparison of endplate/cortex fracture-based and morphometrical deformity-based methods[J]. J Clin Densitom, 2019, 22(3): 409-419. DOI:10.1016/j.jocd.2017.11.004 |
| [3] |
Aquarius R, van der Zijden AM, Homminga J, et al. Does bone cement in percutaneous vertebroplasty act as a stress riser?[J]. Spine(Phila Pa 1976), 2013, 8(24): 2092-2097. |
| [4] |
彭国庆, 范新成, 王震, 等. 经皮椎体后凸成形术后骨水泥用量对骨质疏松性五联椎体模型生物力学的影响[J]. 脊柱外科杂志, 2017, 15(6): 361-365. DOI:10.3969/j.issn.1672-2957.2017.06.010 |
| [5] |
王清泽, 袁欣华, 王相利, 等. 单节段经皮椎体成形术后继发相邻椎体骨折的危险因素[J]. 脊柱外科杂志, 2019, 17(1): 6-10. DOI:10.3969/j.issn.1672-2957.2019.01.002 |
| [6] |
Tsouknidas A, Savvakis S, Asaniotis Y, et al. The effect of kyphoplasty parameters on the dynamic load transfer within the lumbar spine considering the response of a bio-realistic spine segment[J]. Clin Biomech(Bristol, Avon), 2013, 28(9/10): 949-955. |
| [7] |
Takano H, Yonezawa I, Todo M, et al. Biomechanical study of the effects of balloon kyphoplasty on the adjacent vertebrae[J]. J Biomed Sci Eng, 2016, 9(10): 478-487. DOI:10.4236/jbise.2016.910043 |
| [8] |
徐建彪, 张伟学, 王鸿晨, 等. 骨水泥注入量对经皮椎体后凸成形术后相邻椎体应力影响的有限元分析[J]. 脊柱外科杂志, 2017, 15(3): 177-181. |
| [9] |
杨小彬, 贺宝荣, 郝定均, 等. 不同骨水泥量在PKP术后对相邻节段生物力学影响的有限元分析[J]. 中国骨与关节损伤杂志, 2016, 31(1): 40-43. |
| [10] |
Zarrinkalam MR, Beard H, Schultz CG, et al. Validation of the sheep as a large animal model for the study of vertebral osteoporosis[J]. Eur Spine J, 2009, 18(2): 244-253. DOI:10.1007/s00586-008-0813-8 |
| [11] |
陈钵, 秦大平, 张晓刚, 等. 有限元分析法在脊柱生物力学中的研究进展[J]. 中国疼痛医学杂志, 2020, 26(3): 208-211, 216. DOI:10.3969/j.issn.1006-9852.2020.03.009 |
| [12] |
王志坤, 冯庆裕, 张贤森, 等. 脱钙羊椎体模型骨水泥强化术后生物力学研究[J]. 中国骨与关节损伤杂志, 2021, 36(7): 712-714. |
| [13] |
张悦, 李运峰. 骨质疏松症动物模型研究进展[J]. 中国骨质疏松杂志, 2020, 26(1): 152-156. DOI:10.3969/j.issn.1006-7108.2020.01.031 |
| [14] |
陈荣彬, 白杰, 李勇, 等. 骨水泥弥散类型影响胸腰段椎体成形后相邻椎体应力的三维有限元分析[J]. 中国组织工程研究, 2020, 24(30): 4775-4781. DOI:10.3969/j.issn.2095-4344.2841 |
| [15] |
陈贤艺, 陈扬, 陈显辉, 等. 单侧与双侧穿刺PKP术后相邻节段生物力学的三维有限元分析[J]. 中国骨与关节损伤杂志, 2020, 35(1): 56-58. |
| [16] |
Polikeit A, Nolte LP, Ferguson SJ. The effect of cement augmentation on the load transfer in an osteoporotic functional spinal unit: finite element analysis[J]. Spine(Phila Pa 1976), 2003, 28(10): 991-996. |
| [17] |
王德国, 李洋, 尹红灵, 等. 椎体成形术填充剂最优化分布模式三维有限元分析[J]. 中国骨伤, 2021, 34(1): 26-33. |
| [18] |
文毅, 苏峰, 石盛生, 等. 椎体后凸成形术中灌注不同凝固状态骨水泥对骨质疏松性椎体压缩性骨折绵羊椎体生物力学的影响[J]. 脊柱外科杂志, 2021, 19(5): 327-331, 340. |
| [19] |
Martinčič D, Brojan M, Kosel F, et al. Minimum cement volume for vertebroplasty[J]. Int Orthop, 2015, 39(4): 727-733. |
| [20] |
Heini PF, Berlemann U, Kaufmann M, et al. Augmentation of mechanical properties in osteoporotic vertebral bones—a biomechanical investigation of vertebroplasty efficacy with different bone cements[J]. Eur Spine J, 2001, 10(2): 164-171. |
| [21] |
Higgins KB, Harten RD, Langrana NA, et al. Biomechanical effects of unipedicular vertebroplasty on intact vertebrae[J]. Spine(Phila Pa 1976), 2003, 28: 1540-1548. |
| [22] |
Jiang HJ, Xu J, Qiu ZY, et al. Mechanical properties and cytocompatibility improvement of vertebroplasty PMMA bone cements by incorporating mineralized collagen[J]. Materials, 2015, 8(5): 2616-2634. |
| [23] |
Leschinger T, Engel K, Brüggemann GP, et al. Glass-polyalkenoate cement: an alternative material for kyphoplasty in osteoporotic vertebral compression fractures—an ex vivo study[J]. J Mech Behav Biomed Mater, 2018, 83: 46-51. |
| [24] |
欧梁, 孔德忠, 徐道情, 等. 比较聚甲基丙烯酸甲酯与自固化磷酸钙骨水泥在椎体成形中应用效果的Meta分析[J]. 中国组织工程研究, 2022, 26(4): 649-656. |
| [25] |
包拥政, 祝周兴, 冯云升, 等. 低弹性模量骨水泥对骨质疏松压缩性骨折椎体及邻近椎体应力的影响: 三维有限元分析[J]. 中国组织工程研究, 2016, 20(16): 2285-2293. |
| [26] |
Yen CH, Teng MMH, Yuan WH, et al. Preventive vertebroplasty for adjacent vertebral bodies: a good solution to reduce adjacent vertebral fracture after percutaneous vertebroplasty[J]. AJNR Am J Neuroradiol, 2012, 33(5): 826-832. |
| [27] |
Lei F, He W, Tian XG, et al. Prophylactic percutaneous kyphoplasty treatment for nonfractured vertebral bodies in thoracolumbar for osteoporotic patients[J]. Biomed Res Int, 2020, 2020: 8593516. |
| [28] |
Kurutz M, Varga P, Jakab G. Prophylactic vertebroplasty versus kyphoplasty in osteoporosis: a comprehensive biomechanical matched-pair study by in vitro compressive testing[J]. Med Eng Phys, 2019, 65: 46-56. |
| [29] |
Becker S, Garoscio M, Meissner J, et al. Is there an indication for prophylactic balloon kyphoplasty? A pilot study[J]. Clin Orthop Relat Res, 2007, 458: 83-89. |
 2023, Vol.21
2023, Vol.21  Issue(1): 44-49
Issue(1): 44-49


