2. 解放军联勤保障部队第920医院血管外科,昆明 650032
2. Department of Vascular Surgery, No.920 Hospital of Joint Logistics Support Force of Chinese PLA, Kunming 650032, Yunnan, China
腹部血管损伤是腰椎椎间盘突出症手术罕见、严重的并发症,其发生率 < 1%[1]。尽管发生率低,一旦发生,极可能在短时间内发生失血性休克,危及患者生命。本研究回顾性分析了2021年3月4日本院紧急救治的1例后路腰椎椎间盘切除术中发生右侧髂内动脉损伤患者,予以一期紧急填塞止血、二期血管支架修复术,术后患者血管修复,救治成功。现将诊疗过程进行总结分析,以期为该并发症的诊治提供参考,现报告如下。
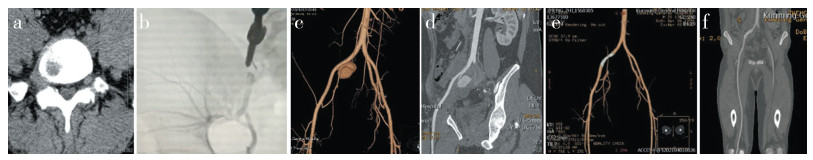
1 病例资料患者,男,21岁,因腰腿痛3个月于2021年3月4日于本院就诊并收住入院。患者自诉3个月前扭伤后出现腰部疼痛,放射致右小腿后外侧,休息后症状部分缓解,3 d后再次扭伤腰部,疼痛难忍。当地医院腰椎CT检查示L5/S1椎间盘突出(极外侧型),相应神经根管变窄;住院予甘露醇脱水等对症支持治疗,未见明显好转,遂转入本院就诊。入院查体:脊柱发育正常,生理曲度存在;L5 ~ S1右侧椎旁压痛,伴右下肢放射痛;右侧直腿抬高试验及加强试验阳性;右胫前肌、踇长伸肌肌力3+级;会阴部感觉正常;右足背痛触觉减退,生理反射存在,病理反射未引出。影像学检查:CT示L5/S1椎间盘突出(极外侧型,图 1a)。根据体征及影像学检查诊断为L5/S1椎间盘突出症(右极外侧型)。患者右下肢放射痛明显,术前疼痛视觉模拟量表(VAS)评分[2]7分,外院非手术治疗效果不佳,有手术指征。考虑到患者为极外侧突出,计划在全身麻醉下行后路L5/S1右侧关节突部分切除、极外侧椎间盘切除、神经根松解、右侧钉棒内固定术。术中切除椎间盘时辅以放大镜,随着髓核钳向上拉出,椎间隙突发大量鲜红色血液涌出,瞬间淹没整个术野;立即予以纱布填塞1 min,期间血压由110/80 mmHg(1 mmHg=0.133 kPa)迅速降至60/40 mmHg;去除纱布,血液涌出速度变缓,予以大量明胶海绵、止血纱布填塞直至无明显出血,并以椎间融合器试模打压至椎间隙前方;随后输注红细胞悬液1 000 mL,血压回升至100/70 mmHg,并维持稳定。迅速缝合切口后急诊转至导管室,由血管外科医师在局部麻醉下行经左侧股动脉穿刺造影术,造影示右侧髂总动脉、髂内外动脉通畅,均未见明显造影剂外漏(图 1b)。患者返回病房,病情持续稳定;术后2周,患者诉右下腹痛,查体生命体征平稳,再次予腹部CT血管造影(CTA),提示右侧髂内动脉起始部假性动脉瘤(图 1c、d);随后转入血管外科予以髂内动脉栓塞、髂总动脉支架术,术后患者腹痛症状消失,复查CTA示髂内动脉瘤封堵成功(图 1e)。术后1年复查右下肢放射痛消失,痛触觉、运动正常,远端循环良好,腹部CTA示右髂内动脉通畅(图 1f)。
|
图 1 病例影像学资料 a:术前CT示L5/S1极外侧型腰椎椎间盘突出 b:术后紧急造影示右侧髂总、髂内、髂外动脉通畅,未见明显造影剂外漏 c:术后2周三维CT示髂内、外动脉交界处假性动脉瘤 d:术后2周冠状位CT示假性动脉瘤位于髂内动脉起始部 e:术后2周安装血管支架后CTA示假性动脉瘤消失 f:术后1年CTA示右髂内动脉通畅 |
约60%腹主动脉-髂动脉损伤为医源性损伤,其死亡率达15%[3]。腹部血管损伤包括血管撕裂、动静脉瘘、假性动脉瘤。腰椎后路手术腹部血管损伤发生率约为0.1%[4]。随着腰椎手术的发展,各种手术入路以及微创手术均广泛应用于临床,同时,腹部大血管损伤也偶有发生。Fujibayashi等[5]的研究显示,行腰椎外侧融合时腹部血管损伤发生率为0.03%;行腰椎前路融合时,其发生率为7.2%[6]。为了确保前路手术的安全,黎斐文等[7]对前路手术进行了解剖研究,完善了前路腰椎手术的解剖基础。此外,内窥镜下腰椎椎间盘切除术也有腹部大血管损伤的报道[8]。尽管腰椎手术腹部血管损伤发生率低,但一旦损伤,极有可能发生大出血,危及患者生命,临床医师须格外重视,在术前应充分评估这一风险。
既往有椎间盘或腹部手术史的患者,术中血管损伤风险增加,这与椎体前部和腹膜后主要血管之间的纤维化和粘连有关。当腰椎正常的解剖结构发生改变时,如椎间盘炎,腹部血管损伤的可能性增加,术中需要更加谨慎,避免医源性腹部血管损伤[9]。后路行腰椎椎弓根螺钉双皮质固定时,也应注意避免伤及血管,Riccio等[10]通过解剖研究证实,当患者俯卧位椎弓根螺钉贯穿前方皮质时,血管损伤的风险明显增加。放大镜和手术显微镜在腰椎术中的使用可增加术野清晰度,但也可能改变术者对视野深度的感知。Akhaddar等[11]的一项荟萃分析发现,100例腰椎后路手术发生腹部血管损伤的患者中有7例在术中使用了光学放大镜。本例患者也使用了放大镜进行手术,可能影响了术者对术野深度的判断,导致髓核钳钳夹髓核时损伤髂内动脉。
2.2 临床表现腰椎术中腹部血管损伤后多表现为急性失血性休克,包括低血压、低血容量性休克、腹部症状和体征及下肢外周动脉表现。但也有部分患者损伤时并无症状,而是在术后数小时出现症状,一般很少在术后48 h后出现。大约一半病例在术中即发现损伤,尤其是椎间隙突发迅猛出血者。然而,有超过10%的腹部血管损伤病例延迟诊断 > 6 h,导致诊断延误的原因主要是误诊,如药物过敏反应[12]。此外,Huttman等[13]报道了1例患者在腰椎椎间盘突出症术后4 d发生肺栓塞,进一步检查发现肺栓塞源于髂总动脉瘤及髂总动静脉瘘,后者为术中损伤所致。Wee等[14]报道了1例患者腰椎术后右下腹疼痛,误诊为阑尾炎,阑尾探查术中发现腹膜后血肿,CT扫描证实为右髂动脉假性动脉瘤破裂。Ventura等[15]报道了1例L5/S1椎间盘切除术后早期发生休克的患者,在急诊探查术前死亡,尸检发现腹部积血1 800 mL,进一步检查证实腹部血管损伤。
综上,在腰椎椎间盘手术中,如发生大量异常出血,外科医师应警惕腹部血管损伤可能。对于术后数小时或48 h内出现的低血压、动脉搏动消失、面色苍白、异常疼痛、下肢皮肤低温伴/不伴腹胀,也应怀疑腹膜后出血或腹部血管损伤。本例患者在使用髓核钳夹取髓核时突发迅猛出血,血液呈鲜红色,血液瞬间填充整个术野,同时伴有血压下降,与大多腹部血管损伤表现一致;尽管随后CTA检查并未发现血管损伤,本研究组仍保持警惕,并在术后2周患者出现右下腹疼痛时进行腹部CTA检查,证实髂内动脉损伤。
2.3 诊断和治疗早期识别、诊断和及时治疗对于预防腹部血管损伤的致命后果至关重要[16]。尽管诊断的金标准仍是CTA,但为了节省时间,一般先采用床旁B超检查,如发现腹膜后血肿或盆腔积液,则提示腹部血管损伤可能。如患者生命体征平稳,则可行腹部CTA检查进一步明确诊断。一旦确诊,应及时治疗。治疗方法的选择主要取决于血管损伤类型及患者的具体情况。血流动力学不稳定的患者建议紧急行腹部探查血管修复。目前,裂口修补、移植物放置和端端吻合仍是修复腹部血管的主要方法。剖腹手术时必须进行仔细检查,因为有可能同时存在内脏损伤[17]。近年来,随着血管外科的不断发展,快速微创血管修复已成为治疗腰椎术中腹部血管损伤的重要方法之一[18]。尽管本例患者术中椎间隙发生迅猛出血,血压骤降,但经过大量明胶海绵及止血纱布填塞并输血,血压恢复正常,并持续至术后2周,因此未行剖腹探查,而是在术后进行CTA检查,在确诊血管损伤部位及类型后选择采用微创血管支架治疗。
在腹部血管损伤的抢救中,控制出血是动脉撕裂伤处理的首要步骤。尽管主动脉阻断可减少出血,但因其并发症较多(包括高死亡率),在危急情况下更多采用开放式主动脉交叉夹紧。目前,血管内球囊阻断主动脉可进一步降低死亡率,已被用作开放式交叉夹紧的替代方法[19]。Liu等[20]对腹部血管损伤抢救的最佳方案提出治疗流程,同时也指出一旦腹腔血管损伤发生,如果条件允许,建议及时行主动脉球囊阻断。Ologun等[21]认为,血管内球囊阻断可作为大量输血复苏和剖腹探查血管修复手术的辅助手段,用于危及生命的腹腔内出血。此外,在抢救过程中,建议行控制性低血压,可以预防紧急剖腹手术血管修复前的大出血。对于血管的修复,目前多采用直接缝合。
分析本例患者,抢救成功基于以下几点因素。首先,发生椎间隙迅猛出血时立即判断出腹部血管撕裂损伤,并紧急采用大量明胶海绵及止血纱布进行填塞止血,这对患者抢救至关重要。后续观察发现,填塞压迫完全可以对髂内动脉损伤进行立即止血,术后2次CTA检查结果证实了这一点。填塞止血简单实用,可在损伤发生时立即对血管进行压迫,降低出血速度,甚至完全压迫止血,为后期抢救争取宝贵时间。其次,尽管患者术后2周内血流动力学稳定,本研究组仍旧保持警惕,当患者出现右下腹痛时,首先考虑夹层动脉瘤,经CTA确诊为髂内动脉瘤。从血管损伤类型转变来看,本研究组认为,初次损伤为髂内动脉撕裂,经过压迫止血后逐渐演变为髂内动脉瘤,再一次验证了血管撕裂很难自愈,此时应采用微创血管内技术治疗。
2.4 术中管理及预防后路腰椎手术损伤腹部血管的主要原因是髓核钳深度把握不当及椎弓根置钉偏外。因此,临床医师在上述过程中应保持警惕。首先,应闭合髓核钳探查椎间盘空间,同时不要插入椎间隙过深,在使用光学放大镜手术时更应注意。Goel等[22]建议术中在切除椎间盘时,先使用刮匙将椎间盘刮碎,再使用髓核钳取出椎间盘碎片,避免大力钳夹、撕扯而误伤腹部血管。此外,在置入椎弓根螺钉时,应反复探查孔道四壁,避免椎弓根螺钉偏外、偏长损伤血管。在制度方面,Takashima等[23]建议中小型医院成立由外科医师、心外科医师和其他医务人员组成的治疗小组,一旦有腹部血管损伤发生,第一时间交由该小组处理,可提高救治成功率。
| [1] |
Denli Yalvac ES, Balak N. The probability of iatrogenic major vascular injury in lumbar discectomy[J]. Br J Neurosurg, 2020, 34(3): 290-298. DOI:10.1080/02688697.2020.1736261 |
| [2] |
Huskisson EC. Measurement of pain[J]. Lancet, 1974, 2(7889): 1127-1131. |
| [3] |
The Japanese society for vascular surgery database management committee member, Ncd vascular surgery data analysis team. Vascular surgery in Japan: 2011 annual report by the Japanese society for vascular surgery[J]. Ann Vasc Dis, 2018, 11(3): 377-397. DOI:10.3400/avd.ar.18-00049 |
| [4] |
Papadoulas S, Konstantinou D, Kourea HP, et al. Vascular injury complicating lumbar disc surgery. A systematic review[J]. Eur J Vasc Endovasc Surg, 2002, 24(3): 189-195. DOI:10.1053/ejvs.2002.1682 |
| [5] |
Fujibayashi S, Kawakami N, Asazuma T, et al. Complications associated with lateral interbody fusion: nationwide survey of 2998 cases during the first 2 years of its use in Japan[J]. Spine(Phila Pa 1976), 2017, 42(19): 1478-1484. DOI:10.1097/BRS.0000000000002139 |
| [6] |
Karhade AV, Bongers MER, Groot OQ, et al. Development of machine learning and natural language processing algorithms for preoperative prediction and automated identification of intraoperative vascular injury in anterior lumbar spine surgery[J]. Spine J, 2021, 21(10): 1635-1642. DOI:10.1016/j.spinee.2020.04.001 |
| [7] |
黎斐文, 吕国华, 王冰. 下腰椎前路腹腔镜椎体间融合术的血管应用解剖[J]. 脊柱外科杂志, 2004, 2(1): 30-32. |
| [8] |
Wang Y, Ai P, Zhan G, et al. Lumbar artery injury during transforaminal percutaneous endoscopic lumbar discectomy: successful treatment by emergent transcatheter arterial embolization[J]. Ann Vasc Surg, 2018, 53: 267.e11-267.e14. DOI:10.1016/j.avsg.2018.05.032 |
| [9] |
Kim DH, Kim TW, Kim MK, et al. Iatrogenic vascular injury occurring during discectomy in a spondylodiscitis patient[J]. Korean J Neurotrauma, 2016, 12(2): 171-174. DOI:10.13004/kjnt.2016.12.2.171 |
| [10] |
Riccio AR, Bishop A, Carl AL. Great vessel excursion: prone versus supine position[J]. Int J Spine Surg, 2019, 13(2): 158-161. DOI:10.14444/6021 |
| [11] |
Akhaddar A, Alaoui M, Turgut M, et al. Iatrogenic vascular laceration during posterior lumbar disc surgery: a literature review[J]. Neurosurg Rev, 2021, 44(2): 821-842. DOI:10.1007/s10143-020-01311-5 |
| [12] |
Singh S, Bhanot A, Bajaj N, et al. Innovative technique of vascular repair in intra-operative IVC rupture during lumbar microdiscectomy: a case report[J]. Arch Trauma Res, 2013, 2(3): 133-135. |
| [13] |
Huttman D, Cyriac M, Yu W, et al. The unusual presentation of a vascular injury after lumbar microdiscectomy: case report[J]. J Neurosurg Spine, 2016, 24(3): 381-384. DOI:10.3171/2015.7.SPINE14256 |
| [14] |
Wee HY, Wang CC, Kuo JR. Vascular injury after lumbar discectomy mimicking appendicitis: report of a case[J]. Asian J Neurosurg, 2015, 10(3): 243-245. DOI:10.4103/1793-5482.161186 |
| [15] |
Ventura F, Barranco R, Bernabei C, et al. A fatal and unusual iatrogenic fourth right lumbar artery injury complicating wrong-level hemilaminectomy: a case report and literature review[J]. Br J Neurosurg, 2019, 33(4): 434-436. DOI:10.1080/02688697.2017.1351523 |
| [16] |
Jung HS, Kim DJ, Kim HS, et al. Vascular complications related to posterior lumbar disc surgery[J]. Vasc Specialist Int, 2017, 33(4): 160-165. DOI:10.5758/vsi.2017.33.4.160 |
| [17] |
Başer A, Alkış O, Toktaş C, et al. A rare cause of ureteral injuries; simultaneous common iliac artery and ureter injury during posterior lumbar disc surgery[J]. Turk J Urol, 2016, 42(2): 108-110. DOI:10.5152/tud.2016.70105 |
| [18] |
Kwinta BM, Myszka AM, Bigaj MM, et al. Iatrogenic common iliac vessel injury during routine degenerative lumbar spine surgery: report of 2 cases and review of literature[J]. World Neurosurg, 2020, 137: 111-118. DOI:10.1016/j.wneu.2020.01.168 |
| [19] |
Abe T, Uchida M, Nagata I, et al. Resuscitative endovascular balloon occlusion of the aorta versus aortic cross clamping among patients with critical trauma: a nationwide cohort study in Japan[J]. Crit Care, 2016, 20(1): 400. DOI:10.1186/s13054-016-1577-x |
| [20] |
Liu B, Ye K, Gao S, et al. The summary of experience of abdominal vascular injury related to posterior lumbar surgery[J]. Int Orthop, 2019, 43(9): 2191-2198. DOI:10.1007/s00264-018-4262-7 |
| [21] |
Ologun G, Sharpton K, Granet P. Successful use of resuscitative endovascular balloon occlusion of the aorta in the treatment of ruptured 8[J]. .5-cm splenic artery aneurysm, J Vasc Surg, 2017(66): 1873-1875. |
| [22] |
Goel A, Kumar P, Bahadur R. Abdominal vascular injury during posterior lumbar discectomy, experience from three cases and review of literature[J]. Spine(Phila Pa 1976), 2019, 44(20): E1227-E1230. DOI:10.1097/BRS.0000000000003100 |
| [23] |
Takashima N, Lee J, Minamidate N, et al. Successful surgery of right common iliac artery injury during lumbar discectomy with endovascular balloon occlusion of the aorta performed by cardiologists[J]. Ann Vasc Dis, 2019, 12(1): 60-62. DOI:10.3400/avd.cr.18-00056 |
 2024, Vol.22
2024, Vol.22  Issue(2): 141-144
Issue(2): 141-144

