2. 上海交通大学医学院附属仁济医院骨科, 上海 200001
2. Department of Orthopaedics, Renji Hospital, Shanghai Jiao Tong University School of Medicine, Shanghai 200001, China
急性脊髓损伤(SCI)多由严重交通事故、高速运动及高空坠落等引起,致残率及致死率高,了解SCI发生发展的机制有助于探寻避免SCI后神经细胞变性、坏死的方法,保护脊髓神经功能[1]。近年来,细胞自噬对SCI的影响受到关注,p62是一种常见的自噬蛋白[2],其在急性SCI后的表达变化及作用尚不清楚。本研究采用SD大鼠建立高空重物垂直坠落打击模型,观察p62在SCI后不同时间点的表达变化,探寻p62与急性SCI是否存在关联。
1 材料与方法 1.1 实验动物与分组SPF级健康成年雌性SD大鼠由海军军医大学实验动物中心提供[动物生产许可证号:SCXK(沪)2012-0003],体质量200 ~ 250 g,随机分为假手术组和造模后1、3、7、14 d组,每组6只。根据实验进展及时补充动物模型。
1.2 动物模型的建立动物实验相关装置和器械均由海军军医大学实验动物中心提供。动物房恒温,室温控制在20℃。大鼠于术前禁食、水8 h。异氟烷吸入麻醉成功后,将大鼠俯卧位置于手术台上,固定头部及躯干,背部手术部位常规消毒。去除T7~9椎板,显露T8脊髓背侧,将预弯的不锈钢片放置在脊髓表面,应用高空重物垂直坠落击打法(Allen法),在离脊髓高约5 cm处,用10 g砝码沿套管垂直落下,造成T8水平脊髓急性SCI模型[3]。SCI模型构建成功评价标准:鼠尾出现痉挛,双下肢痉挛抽搐后表现为完全瘫痪,打击节段脊髓可见水肿、淤血等改变。造模成功后彻底冲洗消毒、清洗切口后逐层关闭切口。术后给予头孢拉定注射液0.25 g肌内注射,切口消毒,每日2次辅助大鼠排尿排便,帮助改变体位,防止压疮发生,注意保暖。造模过程中3只大鼠死亡,立即予以补充。假手术组仅去除T7~9椎板后彻底冲洗消毒、清洗切口后逐层关闭切口。
1.3 观察指标造模成功后,在术后1、3、7、14 d采用国际通用Basso、Beattie、Bresnahan(BBB)评分标准[4]评价大鼠神经功能。神经功能评价完成后处死大鼠,每组随机取3只,获取以受损脊髓为中心上下各1 cm的包含椎体及附件的标本组织,用4%多聚甲醛浸泡固定,48 h后剥离出完整的脊髓组织,再次固定过夜,石蜡包埋、切片。取切片进行常规HE染色,观察脊髓组织的病理学改变。
1.4 脊髓组织中p62的表达检测 1.4.1 实时荧光定量PCR检测每组随机取3个受损脊髓组织,提取总RNA,并反转录合成cDNA。以cDNA为模板进行实时荧光定量PCR反应。p62上游引物为5'-TCCCTGTCAAGCAGTATCC-3',下游引物为5'-TCCTCCTTGGCTTTGTCTC-3';GAPDH上游引物为5'-AATGCATCCTGCACCACCAA-3',下游引物为5'-GATGGCATGGACTGTGGTCA-3'。以GAPDH为内参计算p62的相对表达量。
1.4.2 蛋白质印迹检测每组随机取3个受损脊髓组织,充分裂解后取上清液,用BCA法进行蛋白质定量。取样品与上样缓冲液混合,煮沸后在恒压下进行凝胶电泳。将凝胶上的蛋白质条带转移至硝酸纤维素膜,封闭后分别加入p62抗体和β-actin抗体(稀释比例为1:1 000,英国Abcam公司)和HRP标记山羊抗兔IgG(稀释比例为1:5 000,美国Santa-Cruz公司)孵育,洗膜后观察。
1.4.3 免疫组织化学染色将石蜡包埋的脊髓组织切片脱蜡;蒸馏水冲洗,PBS浸泡;3% H2O2室温孵育,除去内源性过氧化氢酶活性;5% BSA血清封闭,滴加适当稀释度的一抗和二抗工作液,37℃温箱孵育;用DAB显色剂显色,苏木精复染。脱水透明,封片,显微镜下观察。
1.5 统计学处理采用SPSS 19.0软件对数据进行统计学分析。数据采用x±s表示,多组间比较采用单因素方差分析;以P < 0.05为差异有统计学意义。
2 结果 2.1 神经功能评价假手术组术后神经功能BBB评分未见改变,仍为21.00分。造模后1、3、7、14 d组分别为(2.00±0.89)分、(4.67±1.03)分、(7.83±0.75)分、(14.50±1.05)分,与假手术组相比差异均有统计学意义(P < 0.05)。
2.2 病理学改变HE染色结果显示,假手术组大鼠脊髓组织神经元和轴突结构未见明显异常(图 1a,b);建模后1 d组大鼠脊髓组织神经元水肿,白质髓鞘肿胀(图 1c,d);建模后3 d组大鼠脊髓组织神经元进一步水肿,白质髓鞘持续肿胀(图 1e,f);建模后7 d组大鼠脊髓组织神经元逐渐变性,部分坏死,白质髓鞘水肿明显(图 1g,h);建模后14 d组大鼠脊髓组织神经元变性,周围神经元损伤范围扩大,白质髓鞘水肿变性(图 1i,j)。
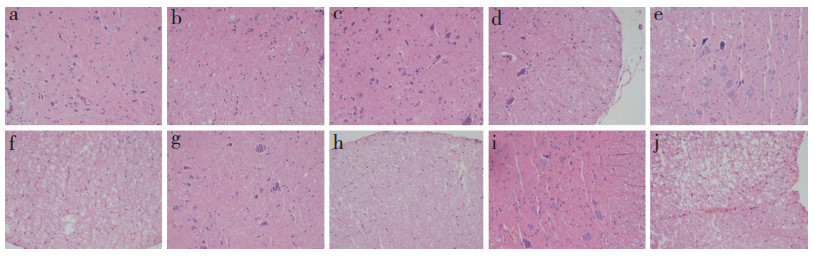
|
a:假手术组神经元正常 b:假手术组髓鞘正常 c:造模后1 d组轻度神经元水肿 d:造模后1 d组轻微髓鞘肿胀 e:造模后3 d组神经元水肿明显 f:造模后3 d组髓鞘肿胀明显 g:造模后7 d组神经元水肿变性 h:造模后7 d组髓鞘肿胀变性 i:造模后14 d组神经元变性坏死 j:造模后14 d组髓鞘肿胀、变性明显 a:Sham group, normal neuron b:Sham group, normal myelin sheath c:SCI 1 d group, mild neuron edema d:SCI 1 d group, slightly swollen myelin sheath e:SCI 3 d group, obvious neuron edema f:SCI 3 d group, swollen myelin sheath g:SCI 7 d group, neuron edema and degeneration h:SCI 7 d group, swollen myelin sheath and degeneration i:SCI 14 d group, neuron degeneration and necrosis j:SCI 14 d group, obvious swollen myelin sheath and degeneration 图 1 大鼠急性SCI后脊髓组织的病理学变化(×200) Fig. 1 Pathological changes of spinal cord tissue after acute SCI in rats(×200) |
实时荧光定量PCR检测结果显示,造模后1、3 d组大鼠脊髓组织中p62水平增高但与假手术组相比差异无统计学意义;随后持续增高,造模后7、14 d组大鼠脊髓组织中p62水平与假手术组相比,差异均有统计学意义(P < 0.05,图 2)。蛋白质印迹检测结果显示,p62蛋白表达量从造模后1 d开始持续增高至14 d(图 3)。免疫组织化学染色检测结果显示,神经元中p62表达主要以细胞核表达为主,在造模后1、3、7、14 d组神经元细胞核中p62表达逐渐增加;胶质细胞的细胞核内p62也有表达,但随着造模时间的延长增加不明显(图 4)。
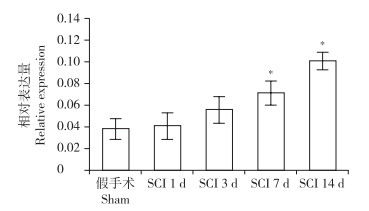
|
注:*与假手术组比较,P < 0.05 Note:* P < 0.05, compared with sham group 图 2 实时荧光定量PCR检测大鼠脊髓组织中p62 mRNA的表达 Fig. 2 p62 mRNA expression of spinal cord tissue in rats detected by quantitative real-time PCR |
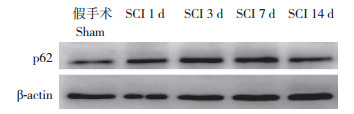
|
图 3 蛋白质印迹检测大鼠脊髓组织中p62蛋白的表达 Fig. 3 p62 protein expression of spinal cord tissue in rats detected by Western blotting |
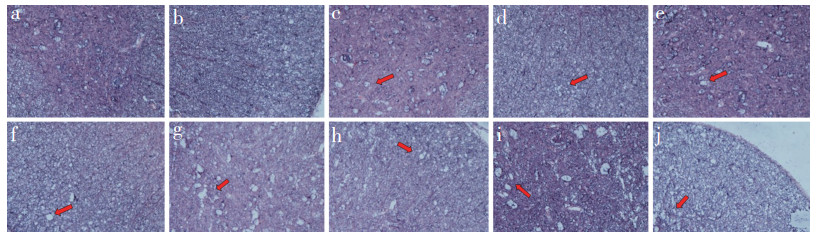
|
a:假手术组p62在神经元细胞核内微量表达 b:假手术组p62在胶质细胞的细胞核内微量表达 c:造模后1 d组p62在神经元细胞核内少量表达 d:造模后1 d组p62在胶质细胞的细胞核内少量表达 e:造模后3 d组p62在神经元细胞核内表达增加 f:造模后3 d组p62在胶质细胞的细胞核内表达略有增加 g:造模后7 d组p62在神经元细胞核内表达增加明显 h:造模后7 d组p62在胶质细胞的细胞核内表达增加不明显 i:造模后14 d组p62在神经元细胞核内的表达明显增加 j:造模后14 d组p62在胶质细胞的细胞核内表达增加不明显 a:Sham group, micro-expression of p62 in nucleus of neuron b:Sham group, micro-expression of p62 in glial nucleus c:SCI 1 d group, p62 expression in a small amount in nucleus of neuron d:SCI 1 d group, p62 expression in a small amount in glial cell nucleus e:SCI 3 d group, p62 expression increase in nucleus of neuron f:SCI 3 d group, p62 expression increase slightly in glial nucleus g:SCI 7 d group, p62 expression increase significantly in nucleus of neuron h:SCI 7 d group, p62 expression without significant increase in glial nucleus i:SCI 14 d group, significantly increased p62 expression in nucleus of neuron j:SCI 14 d group, p62 expression without significant increase in glial nucleus 图 4 免疫组织化学检测大鼠脊髓组织中p62蛋白的表达(×200) Fig. 4 p62 protein expression of spinal cord tissue in rats detected by immunohistochemistry(×200) |
细胞自噬是机体的一种防御机制,细胞通过自噬作用对变性蛋白及衰老细胞器进行吞噬和降解,实现细胞的更新和再循环[5]。在正常情况下,适度的自噬可以维持细胞内环境的稳定,但是如果自噬过度则可能发生细胞自噬性死亡,反而对机体造成损伤[6]。近年来,对于SCI后细胞自噬效应的相关研究越来越多。Kanno等[7]在小鼠的脊髓半切伤模型中发现,小鼠SCI后细胞自噬得到激活,自噬体数量增加明显,在伤后4 h即开始出现,3 d时达到峰值,21 d时仍有表达。Hou等[8]在大鼠模型中也发现了类似结果。Wang等[9]在急性SCI神经元体外细胞模型中发现,细胞自噬体表达量在造模后0.5 h即开始增强,24 h达到峰值,72 h仍有较强表达。上述研究表明,细胞自噬在SCI早期即被激活,自噬体强烈表达。
细胞自噬的活性可以通过透射电子显微镜下观察自噬小体的形成量来确定,其可以作为检测自噬水平的金标准[10];此外,通过测定Beclin1、p62蛋白量以及测定LC3Ⅱ/LC3Ⅰ蛋白的比值也可间接反映细胞自噬的活性[11]。p62蛋白是一种常见的自噬蛋白,也称SQSTM1蛋白,其本质是一种蛋白聚合体[2]。它的表达量增加可导致大脑神经元细胞的减少和轴突退化,在帕金森综合征及阿尔兹海默病中均发现其表达量增加[12]。Tanabe等[13]在小鼠脊髓挤压动物模型和低氧神经元细胞损伤模型中发现,用氯化锂激发细胞自噬后导致p62蛋白积聚增加,并出现低氧效应下的神经元细胞增生,而使用3-甲基嘌呤抑制自噬后则出现相反的结果。
由于临床上很难获得急性SCI受损脊髓组织的病理模型,因此能较好模拟SCI病理过程的动物模型显得尤为重要。理想的动物模型应能精准反映SCI的病理改变全过程,同时有可重复性和可控性。目前SCI模型有很多,不同造模方式导致的损伤性质也不尽相同[14]。钝挫伤模型具有可操控性和可重复性的优点,且约50%截瘫患者的致伤原因为钝挫伤,该模型适用于人类的SCI研究[15]。Allen重物坠落打击模型及其改良模型造成的SCI相对可控、可重复,是国际上较为认可的急性SCI模型[16]。
本研究采用改良Allen法成功建立了急性SCI模型,造模后1、3、7、14 d组BBB神经功能评分与假手术组相比均明显降低,组织学检查发现受损区域脊髓神经元和白质髓鞘发生肿胀并随着损伤时间延长逐渐出现变性、坏死。实时荧光定量PCR和蛋白质印迹分析结果显示,p62蛋白表达量从造模后1 d开始持续增高至14 d;免疫组织化学结果显示,p62在神经元细胞中的表达以细胞核表达为主,并且从造模后1 d即开始增加,一直持续增长至14 d,而在细胞质内表达相对较少,提示p62对自噬作用的影响可能发生在转录水平而非转录后水平。
本研究存在一定局限性。改良Allen法制作模型时,砝码坠击后无法及时移开,造成不同程度的脊髓压迫伤,坠击后反弹可能造成二次乃至多次打击,与临床急性SCI受损机制不完全相符;且实验周期较短,随着时间推移,p62在神经元细胞核内的表达是否会继续增高,还是趋于稳定或者逐渐减少,有待进一步观察。
| [1] |
Warner FM, Cragg JJ, Jutzeler CR, et al. Early administration of gabapentinoids improves motor recovery after human spinal cord injury[J]. Cell Rep, 2017, 18(7): 1614-1618. DOI:10.1016/j.celrep.2017.01.048 |
| [2] |
Zhang YB, Gong JL, Xing TY, et al. Autophagy protein p62/SQSTM1 is involved in HAMLET-induced cell death by modulating apotosis in U87MG cells[J]. Cell Death Dis, 2013, 4: e550. DOI:10.1038/cddis.2013.77 |
| [3] |
Guo X, Yu TY, Steven W, et al. "Three Methods and Three Points" regulates p38 mitogen-activated protein kinase in the dorsal horn of the spinal cord in a rat model of sciatic nerve injury[J]. Neural Regen Res, 2016, 11(12): 2018-2024. DOI:10.4103/1673-5374.197147 |
| [4] |
Basso DM, Beattie MS, Bresnahan JC, et al. A sensitive and reliable locomotor rating scale for open field testing in rats[J]. J Neurotrauma, 1995, 12(1): 1-21. DOI:10.1089/neu.1995.12.1 |
| [5] |
Solhaug A, Torgersen ML, Holme JA, et al. Autophagy and senescence, stress responses induced by the DNAdamaging mycotoxin alternariol[J]. Toxicology, 2014, 326: 119-129. DOI:10.1016/j.tox.2014.10.009 |
| [6] |
占贞贞, 陈祥, 张赟恺, 等. 自噬及其作用的相对性[J]. 第二军医大学学报, 2016, 37(10): 1189-1194. |
| [7] |
Kanno H, Ozawa H, Sekiguchi A, et al. Spinal cord injury induces upregulation of Beclin 1 and promotes autophagic cell death[J]. Neurobiol Dis, 2009, 33(2): 143-148. DOI:10.1016/j.nbd.2008.09.009 |
| [8] |
Hou H, Zhang L, Zhang L, et al. Acute spinal cord injury in rats induces autophagy activation[J]. Turk Neurosurg, 2014, 24(3): 369-373. |
| [9] |
Wang ZY, Lin JH, Muharram A, et al. Beclin-1-mediated autophagy protects spinal cord neurons against mechanical injury-induced apoptosis[J]. Apoptosis, 2014, 19(6): 933-945. DOI:10.1007/s10495-014-0976-1 |
| [10] |
Klionsky DJ. The molecular machinery of autophagy:unanswered questions[J]. J Cell Sci, 2005, 118(Pt 1): 7-18. |
| [11] |
Kanki T, Klionsky DJ. The molecular mechanism of mitochondria autophagy in yeast[J]. Mol Microbiol, 2010, 75(4): 795-800. DOI:10.1111/j.1365-2958.2009.07035.x |
| [12] |
Nagaoka U, Kim K, Jana NR, et al. Increased expression of p62 in expanded polyglutamine-expressing cells and its association with polyglutamine inclusions[J]. J Neurochem, 2004, 91(1): 57-68. DOI:10.1111/j.1471-4159.2004.02692.x |
| [13] |
Tanabe F, Yone K, Kawabata N, et al. Accumulation of p62 in degenerated spinal cord under chronic mechanical compression:functional analysis of p62 and autophagy in hypoxic neuronal cells[J]. Autophagy, 2011, 7(12): 1462-1471. DOI:10.4161/auto.7.12.17892 |
| [14] |
Moore SA, Oglesbee MJ. Spinal cord ependymal responses to naturally occurring traumatic spinal cord injury in dogs[J]. Vet Pathol, 2015, 52(6): 1108-1117. DOI:10.1177/0300985814560235 |
| [15] |
Xu P, Gong WM, Li Y, et al. Destructive pathological changes in the rat spinal cord due to chronic mechanical compression. Laboratory investigation[J]. J Neurosurg Spine, 2008, 8(3): 279-285. DOI:10.3171/SPI/2008/8/3/279 |
| [16] |
Miyamoto S, Yonenobu K, Ono K. Experimental cervical spondylosis in the mouse[J]. Spine(Phila Pa 1976), 1991, 16(10 Suppl): S495-S500. |
 2019, Vol.17
2019, Vol.17  Issue(5): 350-354
Issue(5): 350-354


